
下列说法正确的是
A.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同
【知识点】 有机物的鉴别;相似相溶原理及其应用;油脂的性质、组成与结构 L6 L7
【答案解析】A 解析:A.含-OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷,故A正确; B.HCOOCH3中两种H,HCOOCH2CH3中有三种H,则用核磁共振氢谱能区分HCOOCH3和HCOOCH2CH3,故B错误; C.CH3COOH与碳酸钠溶液反应气泡,而Na2CO3溶液与CH3COOCH2CH3会分层,因此可以用Na2CO3溶液能区分CH3COOH和CH3COOCH2CH3,故C错误; D.油脂在酸性条件下水解产物为高级脂肪酸和甘油,碱性条件下水解产物为高级脂肪酸盐和甘油,水解产物不相同,故D错误。
【思路点拨】本题考查了有机物的鉴别,为高频考点,把握常见有机物的性质及鉴别方法为解答的关键,注意溶解性与-OH的关系、油脂不同条件下水解产物等,题目难度不大。


科目:高中化学 来源: 题型:
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
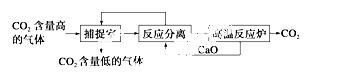
下列有关该方法的叙述中正确的是 ( )
①能耗大是该方法的一大缺点
②整个过程中,只有一种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
R代表氢元素或钠元素,与RF<RCl<RBr<RI的变化规律不符的卤化合物的性质是
A.卤化氢的热稳定性
B.遇氧化剂时表现出的还原性强弱
C.与硝酸银溶液反应生成的沉淀颜色深浅
D.卤化氢水溶液的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与含氯化合物有关的说法正确的是 ( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
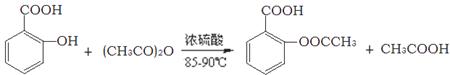
阿司匹林的有效成分是乙酰水杨酸(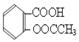 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
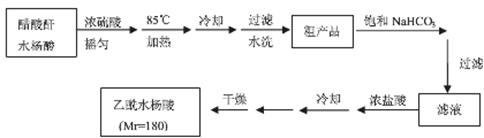
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是 。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式 。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是 。判断该过程结束的方法是 。
② 滤液缓慢加入浓盐酸中,看到的现象是 。
③ 检验最终产品中是否含有水杨酸的化学方法是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):Ⅰ.称取阿司匹林样品m g;
Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式: 。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B. 酸性氧化物一定不能和酸反应
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
近两年来,“雾霾”一直是人们所关注的对象,下图为雾霾的主要成分示意图。下列说法不正确的是( )
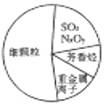 A.SO2和NxOy溶于水均只生成酸
A.SO2和NxOy溶于水均只生成酸
B.重金属离子可导致蛋白质变性
C.苯是最简单的芳香烃
D.大量燃烧化石燃料时造成雾霾天气的一种重要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所
含质子的物质的量是 ( )
A.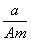 (A-N+m) mol B.
(A-N+m) mol B.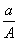 (A-N) mol
(A-N) mol
C.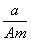 (A-N) mol D.
(A-N) mol D.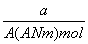
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:
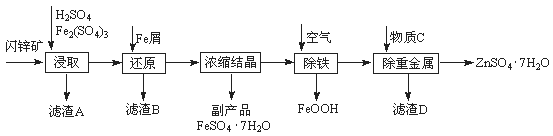 (1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com