
| A. | 硫离子的结构示意图为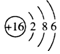 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
分析 A、硫离子是硫原子得到两个电子形成的;
B、核外电子排布相同的微粒不一定属于同一种元素;
C、同种元素的不同种原子间互为同位素;
D、同种元素的不同种原子具有相同的质子数.
解答 解:A、硫离子是硫原子得到两个电子形成的,故核外有18个电子,结构示意图为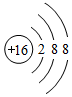 ,故A错误;
,故A错误;
B、核外电子排布相同的微粒不一定属于同一种元素,如钠离子和镁离子的核外电子排布相同,但化学性质不同,故B错误,
C、同种元素的不同种原子间互为同位素,2H、3H同是氢元素的两种氢原子,故互为同位素,故C正确;
D、同种元素的不同种原子具有相同的质子数,但中子数不同,故D错误.
故选C.
点评 本题考查和离子结构示意图和同位素的概念等,难度不大,应注意的是同位素的化学性质相同,但具有相同电子数的微粒的化学性质不一定相同.


科目:高中化学 来源: 题型:选择题
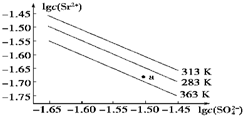
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
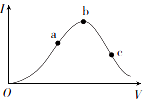 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
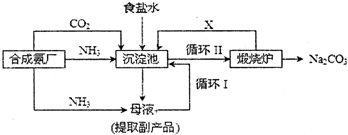
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com