
分析 (1)纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;非电解质是在水溶液里或熔融状态下都不能导电的化合物,前提必须是化合物;
(2)Fe ( OH )3胶体带正电,存在自由移动的带电微粒即可导电;
(3)反应生成醋酸钠和水,醋酸和水在离子反应中应保留化学式;
(4)硫酸氢钾电离生成钾离子和硫酸氢根;
(5)碳酸钡能与硫酸氢钾反应生成硫酸钡和二氧化碳等;
(6)溶液中n(NaOH)=0.4mol,则n(NaOH):n(CO2)=0.4mol:0.3mol=4:3=1:0.75,介于2:1与1:1之间,故发生反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,且NaOH、CO2无剩余,溶液中溶质为Na2CO3、NaHCO3.令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,根据钠元素守恒、碳元素守恒列方程计算a、b的值.
解答 解:(1)①NaOH 溶液⑤Fe ( OH )3胶体是分散系,是混合物,②液氨⑦CO2在水溶液里或熔融状态下都不能导电,是非电解质,故答案为:①⑤;②⑦;
(2)Fe ( OH )3胶体带正电,向阴极移动,阴极颜色加深,阳极颜色变浅,存在自由移动的带电微粒即可导电,故答案为:阴极颜色加深,阳极颜色变浅;④⑥;
(3)醋酸(CH3COOH)和氢氧化钠溶液反应生成醋酸钠和水,该离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(4)硫酸氢钾电离生成钾离子和硫酸氢根,电离方程式:KHSO4=K++HSO4-,故答案为:KHSO4=K++HSO4-;
(5)碳酸钡能与硫酸氢钾反应生成硫酸钡和二氧化碳等,离子方程式为:BaCO3+2H++SO42-═Ba2++BaSO4+2H2O+CO2↑,故答案为:BaCO3+2H++SO42-═Ba2++BaSO4+2H2O+CO2↑;
(6)溶液中n(NaOH)=0.4mol,则n(NaOH):n(CO2)=0.4mol:0.3mol=4:3=1:0.75,介于2:1与1:1之间,故发生反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,且NaOH、CO2无剩余,溶液中溶质为Na2CO3、NaHCO3.
令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,则:
根据钠元素守恒有:2a+b=0.4
根据碳元素守恒有:a+b=0.3
联立解得:a=0.1,b=0.2
则n(Na2CO3):n(NaHCO3)=0.1mol:0.2mol=1:2
离子方程式4OH-+3CO2=CO32-+2HCO3-+H2O,故答案为:Na2CO3和NaHCO3;4OH-+3CO2=CO32-+2HCO3-+H2O.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
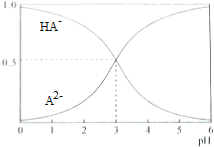
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mlCuSO4溶液的试管里加入2mlNaOH溶液,观察现象 | Cu2++2OH-═Cu(OH)2↓ |
| Ⅱ.向盛有2mL pH=1的HCl溶液的试管里慢慢滴入18mL(已足量)CH3COONH4溶液(查资料知CH3COONH4,溶液呈中性 )震荡摇匀,测得pH≈3.7 | |
| Ⅲ向盛有2mLNaHCO3溶液的试管里加入2mL H2SO4溶液,观察现象 | HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
| Ⅳ向盛有2mL 稀Na2SO4溶液的试管里加入2mL稀KCl溶液,观察无明显现象 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 定样品中Na2O2的含量.
定样品中Na2O2的含量.
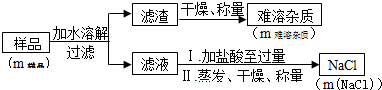
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则含有2NA个原子 | |
| B. | 常温常压下,16g氧气和32 g臭氧(O3)所含氧原子总数为3NA | |
| C. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3mol二氧化碳中含有氧原子数0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com