
【题目】由A、B、C、D四种金属按下表中装置进行实验,根据实验现象填表:

现象 | (I)金属A逐渐溶解 | (Ⅱ)C的质量增加 | (Ⅲ)A上有气体产生 |
填正极反应式 | ___ | ___ | |
四种金属活动性由强到弱的顺序:___。 | |||
若装置(Ⅲ)中A极产生的气体在标准状况下的体积为224mL,则通过导线中的电子的物质的量为___mol。 | |||
【答案】2H++2e-=H2↑ Cu2++2e-=Cu D>A>B>C 0.02
【解析】
第一个原电池中,A金属不断溶解,说明A易失电子而作负极,B作正极,越容易失电子的金属活动性越强,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑;第二个原电池中,C的质量增加,说明C上的铜离子得电子发生还原反应而作正极,电极反应式为:Cu2++2e-=Cu,B为负极,B的金属性大于C;第三个原电池中,A上有气体产生,说明A上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,D失电子作负极,所以D的活动性大于A;所以金属性强弱顺序是D>A>B>C;若装置(Ⅲ)中A极电极反应式为:2H++2e-=H2↑,标准状况下体积为224mL的H2物质的量为0.01mol,则转移电子的物质的量为0.02mol。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
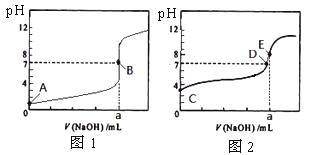
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量
请回答下列问题:
(1)该实验的目的是_________________
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g若要将所称取的样品恰好溶解,最多需要蒸馏水____________g,溶解样品所需的仪器是________________
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
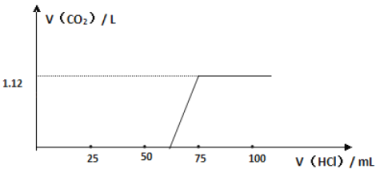
则13.3 g 该样品中未变质的NaOH的质量为____________;NaOH的变质程度为_________(用质量分数表示);与NaOH反应消耗的盐酸体积为________mL
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图像,他们从实验中还发现了什么问题?_____________________,并由此得出了什么结论?____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为VL的固定容积的容器中发生反应:A(g)+B(g)![]() 3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
①单位时间内生成C的分子数与分解C的分子数相等②外界条件不变时,ABC的浓度不随时间变化③体系温度不再变化④体系的分子总数不再变化 ⑤反应速率3v(B)=v(C)
A.①②B.①②③
C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:
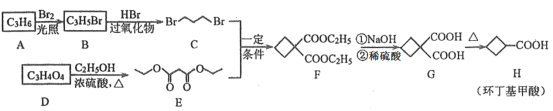
回答下列问题:
(1)A的结构简式为__________。
(2)B→C的反应类型为__________。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为____________。
(3) D→E的化学方程式为_____________。
(4) M是H的同分异构体,写出同时满足下列条件的M的结构简式_____________。(不考虑立体异构)
①1molM与足量银氨溶液反应生成4molAg;②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为_______,乙的结构简式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,日本食品巨头明治公司生产的“明治STEP”奶粉中检测出含量超标的放射性元素铯(Cs)。铯较为稳定的核素有![]() 、
、![]() 、
、![]() 、
、![]() 。下列判断不正确的是( )
。下列判断不正确的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 互为同位素
互为同位素
B. ![]() 、
、![]() 、
、![]() 、
、![]() 的核外电子排布相同
的核外电子排布相同
C. ![]() 、
、![]() 、
、![]() 、
、![]() 的性质和用途相同
的性质和用途相同
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的质量数和中子数均不同
的质量数和中子数均不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
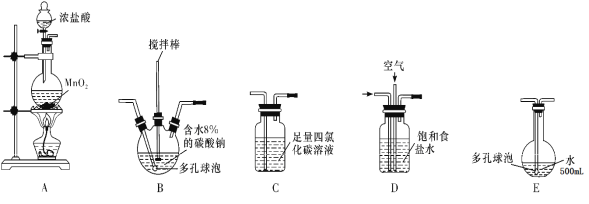
回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F是六种不同物质,A是单质,B和E都是酸,它们之间的反应关系如图所示(部分物质已略)分析辨识,解决问题:
(1)B和C反应的化学方程式是_____________,基本反应类型是________。
(2)D生成A的化学方程式是______________________________ (写一个即可)。
(3)若F与其他物质类别不同,E和F反应的微观实质是________________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com