

| A��0��b��ķ�Ӧ�����������ӷ���ʽ��ʾ��3HSO3����IO3��=3SO42����I����3H�� |
| B��a��ʱ����NaHSO3�����ʵ���Ϊ0.12mol |
| C������Һ��I����I2�����ʵ���֮��Ϊ5��2ʱ�������KIO3Ϊ0.18mol |
| D��b��ʱ�Ļ�ԭ���������KI��NaI��b��c��Ļ�ԭ������I2 |
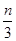 �����ĵ����ӵ���Ϊ
�����ĵ����ӵ���Ϊ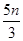 �����ݷ�Ӧ3HSO3����IO3����3SO42����I����3H����֪��0.3molNaHSO3����Һ����KIO3��Һ�����ʵ���Ϊ0.1mol�����ɵ����ӵ����ʵ���Ҳ��0.1mol����0.1mol��
�����ݷ�Ӧ3HSO3����IO3����3SO42����I����3H����֪��0.3molNaHSO3����Һ����KIO3��Һ�����ʵ���Ϊ0.1mol�����ɵ����ӵ����ʵ���Ҳ��0.1mol����0.1mol��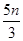 ��2.5n�����
��2.5n�����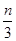 ��
��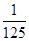 mol���������ĵ���ص����ʵ����ǣ�
mol���������ĵ���ص����ʵ����ǣ�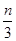 ��0.1mol����0.108mol��C����ȷ��D���������Ϸ�����֪��b��ʱ�Ļ�ԭ���������KI��NaI��b��c��Ļ�ԭ������I2��D��ȷ����ѡC��
��0.1mol����0.108mol��C����ȷ��D���������Ϸ�����֪��b��ʱ�Ļ�ԭ���������KI��NaI��b��c��Ļ�ԭ������I2��D��ȷ����ѡC��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
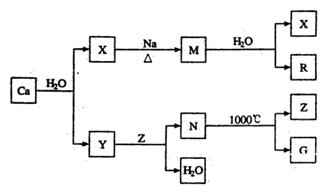
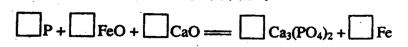
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
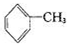 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______��
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______��A����������Ϊ | B�� �������� �������� |
| C��ÿ1mol KMnO4ת��5mol e- | D��H2SO4��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��+1 | B��+2 | C��+3 | D��+4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 MnCl2 + C12�� + 2H2O������˵������ȷ����( )
MnCl2 + C12�� + 2H2O������˵������ȷ����( ) | A����ԭ����HCl����������MnO2 |
| B��ÿ����1 mol Cl2��ת�Ƶ��ӵ����ʵ���Ϊ2 mol |
| C��ÿ����1 mol MnO2����ԭ�����õ�HCl����4 mol |
| D��ת�Ƶ��ӵ����ʵ���Ϊ1molʱ�����ɱ�״����Cl2�����Ϊ11.2L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��������Һ�г�ַ�Ӧ������NO���壬���ó�����Һ�ɷֿɿ�����Fe��NO3��3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ
��������Һ�г�ַ�Ӧ������NO���壬���ó�����Һ�ɷֿɿ�����Fe��NO3��3��H2SO4�Ļ��Һ����Ӧ��δ����ԭ���������Ϊ mol
mol| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com