
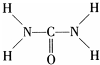
 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.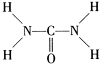 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断; 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,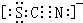 ,故答案为:配位键;K2Fe(SCN)5;
,故答案为:配位键;K2Fe(SCN)5;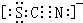 .
.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| A、从组成看,其成分皆是碱性氧化物 |
| B、溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+ |
| C、沉淀X的成分是SiO2 |
| D、在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
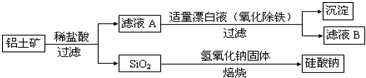
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOCH3 |
| B、HCOOCH3 |
| C、HCOOCH2CH3 |
| D、HCOOCH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器内压强不随时间变化 |
| B、P和S的生成速率相等 |
| C、反应容器内P、Q、R、S四者共存 |
| D、反应容器内总物质的量不随时间而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com