
| A. | V(B2)=0.8mol/(L•s) | B. | V(A2)=0.4mol/(L•s) | C. | V(C)=0.6mol/(L•s) | D. | V(B2)=1.8mol/(L•s) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用如图装置制取Cl2,证明产生的气体中含有HCl.| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | 先变红后褪色 |
| b | AgNO3溶液 | 出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在墙壁刚粉刷过石灰浆的室内生一炭火盆,墙壁会“冒汗” | |
| B. | 以二氧化硅为主要原料制造光导纤维 | |
| C. | 碳炉边放盆水,可防止煤气中毒 | |
| D. | 用干冰进行人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为缩聚反应 | |
| B. | PPV是聚苯乙炔 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol  最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
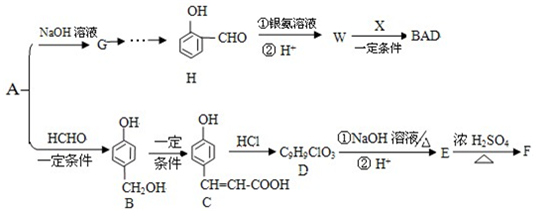
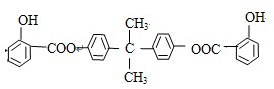
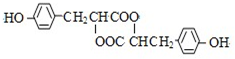
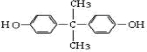 ,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子.
,推测B的核磁共振氢谱中显示有5种不同化学环境的氢原子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com