
| A. | A<B<C<D | B. | D<A<B=C | C. | A=B<C=D | D. | D<A<B<C |
分析 先根据反应方程式计算出反应后溶液的质量,然后根据钠原子守恒计算出溶质的物质的量及质量,最后根据w=$\frac{m(溶质)}{m(溶液)}$×100%计算出溶液的质量分数.
解答 解:钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+$\frac{1}{2}$H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:$\frac{4g}{100g+2.2g}$×100%、$\frac{8g}{100g+6.2g}$×100%、$\frac{8g}{100g+6.2g}$×100%、$\frac{4g}{100g+4g}$×100%,
所以A、B、C、D的质量分数大小的顺序是:D<A<B=C.
故选B.
点评 本题考查了钠及其化合物的性质、溶质质量分数的计算及比较,题目难度较大,明确溶液质量增加的量是解本题的关键,注意掌握钠及其化合物的性质及溶质的质量分数的计算方法.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
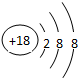 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.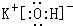 .
.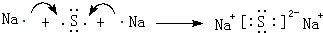 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.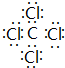 、
、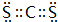 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
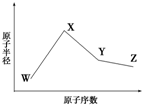 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CH4中含有的氢原子数为2NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2NA | |
| C. | 1 mol Na与足量水反应后转移的电子数为NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固体)混合搅拌发生的是吸热反应 | |
| D. | 键能越大物质能量越高,物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 准确测量中和热的实验过程中,至少需测定温度4次 | |
| C. | 环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| D. | 若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com