
50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________.
(2)烧杯间填满碎纸条的作用是_________.
(3)若大烧杯上不盖硬纸板,求得中和热数值_________(填“偏大”“偏小”或“无影响”).
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”),简述理由_________.
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 mol·L-1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会_________(填“偏大”“偏小”或“无影响”).
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:浙江省诸暨中学2011-2012学年高一上学期期中考试化学试题 题型:013
|
下列溶液中,与50 mL 0.5 mol/L AlCl3溶液所含Cl-的物质的量浓度相同的是 | |
| [ ] | |
A. |
100 mL 0.375 mol/L MgCl2溶液 |
B. |
200 mL 0.25 mol/L FeCl3溶液 |
C. |
50 ml 1.5 mol/L NaCl溶液 |
D. |
100 ml 0.15 mol/L NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源:新疆乌鲁木齐八中2010-2011学年高二第一次月考化学试题(平行班) 题型:058
实验室用50 mL 0.5 mol/L盐酸、50 mL 0.55 mol/LNaOH溶液在下图所示装置进行测定中和热的实验,放出的热为Q

请回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是________.不能用铜丝搅拌棒代替环形玻璃棒的理由是________.塑料的作用是________.
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,
测得放热为Q1,则Q1与Q的关系为:Q1________Q(填“<”、“>”或“=”),理由是________
查看答案和解析>>
科目:高中化学 来源:吉林省长春外国语学校2011-2012学年高二上学期期中考试化学理科试题 题型:058
中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50 mL 0.5 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________,烧杯间填满碎塑料泡沫的作用是________
(2)大烧杯上如不盖硬纸板,则求得的中和热数值________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,所求中和热的数值会________(填“相等”或“不相等”)
查看答案和解析>>
科目:高中化学 来源:山东省高青一中2009-2010学年度高二上学期期末模块检测考试化学试题 题型:058
酸碱中和反应是中学化学一类重要的反应,其反应的本质都是H+和OH-反应生成H2O.某学生实验小组对课本中的两个酸碱中和实验进行了模拟研究.
(1)用下图装置进行强酸(50 mL 0.5 mol/L的HCI)和强碱(50 mL 0.55 mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是________;
②大小烧杯之间填满纸屑的作用是________;
③向组装好的量热器中加入50 mL盐酸并测定温度,取出温度计并冲
净后,再将已测定好温度的NaOH溶液50 mL加入量热器.下列加入50 mL NaOH溶液的操作正确的是________.
A.为了使酸碱充分中和,必须边滴加NaOH溶液边迅速搅拌
B.把50 mL NaOH溶液一次迅速倒入,盖上纸板迅速搅拌.
④若用醋酸代替上述盐酸实验,实验测得的中和热值________(填偏大、偏小或无影响).
(1)、用实验室准确配制的0.100 mol/L的NaOH溶液测定某未知浓度的稀盐酸.
其具体实验步骤如下:
①取一支碱式滴定管下图中有两只滴定管~上端未画出,你选择哪一只?________(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100 mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00 mL待测盐酸,置于用蒸馏水洗净的锥形瓶中,再加入酚酞(变色范围:8.2~10.0)试液2滴;
③滴定时,边滴边振荡,同进注视眼睛注视锥形瓶内容也颜色的变化,当锥形瓶内溶液由________(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
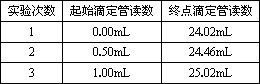
测得未知稀盐酸的物质的量浓度为________(保留小数点后3位).
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果~稀盐酸浓度的影响是________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源:志鸿系列全优设计必修一化学苏教版 苏教版 题型:021
|
将50 mL 0.5 mol·L-1的Al2(SO4)3溶液加入4.0 mol·L-1的NaOH溶液可得到1.56 g沉淀,则消耗NaOH的体积是
| |
A. |
45 mL |
B. |
30 mL |
C. |
15 mL |
D. |
60 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com