
 (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.分析 (1)Cu和稀硫酸不能自发进行,要使Cu+H2SO4(稀)=CuSO4+H2↑能发生,需要将该反应的装置设计成电解池,且Cu作阳极,可以用石墨作阴极,硫酸作电解质;
(2)如果将Cu、石墨与电源接反了,则Cu电极上得到氢气、石墨电极上得到氧气.
解答 解:(1)Cu和稀硫酸不能自发进行,要使Cu+H2SO4(稀)=CuSO4+H2↑能发生,需要将该反应的装置设计成电解池,且Cu作阳极,可以用石墨作阴极,硫酸作电解质,则该装置图为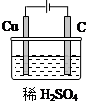 ,故答案为:
,故答案为: ;
;
(2)如果将Cu、石墨与电源接反了,则Cu作阴极、石墨作阳极,Cu电极上水得电子生成氢气、石墨电极上水失电子生成氧气,实质上是电解水,如果碳棒和铜棒上都有气泡产生且铜棒没有被腐蚀,原因是两极与电源的正负极接反了(或铜棒接电源的负极了等),
故答案为:两极与电源的正负极接反了(或铜棒接电源的负极了等).
点评 本题考查电解池设计,为高频考点,侧重考查学生综合知识应用能力,正确判断该反应能设计成哪种类型电池是解本题关键,注意:Cu和稀硫酸不反应,加热条件下能和浓硫酸反应,为易错题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
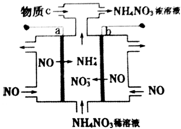
| A. | b为阳极,连接电源的正极 | |
| B. | 阴极反应式为3NO+15e-+18H+═3NH4++3H2O | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的物质c为HNO3 | |
| D. | 总反应式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2NHO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
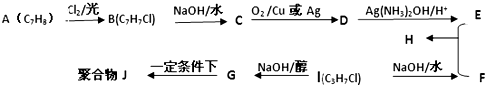
 ,C的官能团名称醇羟基.
,C的官能团名称醇羟基. .
. .
.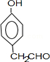 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mL | B. | 20mL | C. | >20mL | D. | <20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaOH═Na++O2-+H+ | D. | Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com