
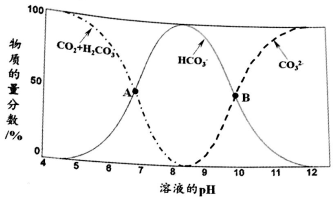
分析 (1)①a.图象分析可知,PH=8时碳酸氢根离子物质的量分数最大,;
b.A点是碳酸氢根离子物质的量分数和二氧化碳的碳酸溶液中物质的量分数相同;
c.图象分析可知当c(HCO3-)=c(CO32-)时,PH=10;
②pH=8.4的水溶液中主要是碳酸氢钠溶液,加入NaOH溶液时发生反应为碳酸氢钠和氢氧化钠溶液反应生成碳酸钠和水;
(2)①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3.是二氧化碳和氢氧根离子、钙离子分数的反应生成碳酸钙和水;
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3 >H2CO3>HSO3->HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子;
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子;
②与新鲜海水混合同时鼓入大量空气排出部分CO2,会导致海水pH增大.
解答 解:(1)①a.图象分析可知,PH=8时主要存在的微粒是碳酸氢根离子,溶液中含碳元素的微粒主要是HCO3-,故a正确;
b.A点是碳酸氢根离子物质的量分数和二氧化碳的碳酸溶液中物质的量分数相同,溶液中H2CO3和HCO3-浓度不相同,故b错误;
c.图象分析可知当c(HCO3-)=c(CO32-)时,PH=10溶液显碱性,c(H+)<c(OH-),故c错误;
故答案为:bc;
②pH=8.4的水溶液中主要是碳酸氢钠溶液,加入NaOH溶液时发生反应为碳酸氢钠和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O,
故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3 >H2CO3>HSO3->HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:SO2+HCO3-=CO2+HSO3-,
故答案为:SO2+HCO3-=CO2+HSO3-;
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+,
故答案为:O2+2HSO3-=2SO42-+2H+;
②上述方式使处理后海水pH升高的原因是与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2,
故答案为:与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2.
点评 本题考查了海水资源的利用、主要是离子性质、离子反应和离子方程式书写,掌握基础是解题关键,题目难度中等.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,任何气体的分子间距离几乎相等 | |
| B. | 标准状况下,22.4LCCl4的物质的量是1mol | |
| C. | 等物质的量的N2和CO所含有的原子数均为2NA | |
| D. | 物质的量是科学上用来表示物质所含微粒质量的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化目的是为了提高轻质油产量和质量 | |
| B. | 淀粉、纤维素、油脂都是高分子化合物 | |
| C. | 可以通过分液的方法分离乙酸乙酯和水的混合物 | |
| D. | 紫外线、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 gH218O含有的中子数为5NA | |
| B. | 标准状况下,2.24LCH2Cl2含有的分子数为0.l NA | |
| C. | 1 mol氯气参加反应时,电子转移数目一定为2NA | |
| D. | 常温下,pH=6的纯水中OH-的数目为10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40gNaOH的稀溶液与足量稀醋酸完全中和放出的热量小于57.3kJ | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,此反应的△H变为-46.2kJ•mol-1 | |
| C. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ•mol-1,则氢气燃烧热为285.8kJ/mol | |
| D. | 已知S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 称量用的砝码已生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com