
2现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A) ; (B) ;(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是 ; 电解质溶液是 .(填化学式)
②写出电极反应式:负极 ;正极 .
③若导线上转移电子1mol,则负极质量变化 g.
考点: 设计原电池.
分析: (1)原电池反应是自发进行的放热的氧化还原反应;
(2)根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液;
根据转移电子和Cu之间的关系式计算消耗Cu的质量.
解答: 解:(1)原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,不能设计成原电池,(B)中Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以(B)能设计成原电池,
故答案为:能;不能;
(2)①根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极、FeCl3溶液作电解质溶液,
故答案为:Cu;FeCl3溶液;
②负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,所以负极、正极反应式分别为Cu﹣2e﹣=Cu2+、2Fe3++2e﹣=2Fe2+,故答案为:
Cu﹣2e﹣=Cu2+;2Fe3++2e﹣=2Fe2+;
③根据负极反应式Cu﹣2e﹣=Cu2+得消耗m(Cu)= =32g,
=32g,
故答案为:32.
点评: 本题考查原电池设计,明确原电池原理及原电池反应特点是解本题关键,侧重考查学生知识运用能力,难点是判断正负极及电解质溶液,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
有关能源的下列说法不正确的是( )
|
| A. | 煤、石油、天然气都是化石能源 |
|
| B. | 氢能、核能都是无污染的可再生能源 |
|
| C. | 氢能是可再生能源 |
|
| D. | 化石能源是非再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“柯达尔”是一种高聚物,其结构式为:
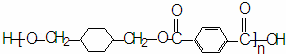
已知在一定条件下可以发生如下反应: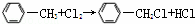
以石油产品(对二甲苯)为原料,合成“柯达尔”的方案如下:

回答以下问题:
(1)指出反应的类型:A→B: ,A→E: .
(2)写出下列反应的化学方程式:B→C: ;E→F: ;D+F→柯达尔: .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)⇌2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol N2 的同时,生成3n mol H2
②断开1mol H﹣H键的同时断开2molN﹣H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变.
A. ②④ B. ①④ C. ①③④ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是可逆反应X2+3Y2⇌2Z2 在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是( )

A. t1时,只有正方向反应
B. t2时,反应到达限度
C. t2﹣t3,反应不再发生
D. t2﹣t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 2 3 4 5 6 7 8 9 …
C2H2 C2H4 C2H6 C3H4 C3H6 C3H8 C4H6 C4H8 C4H10
A. C6H12 B. C6H14 C. C7H12 D. C7H14
查看答案和解析>>
科目:高中化学 来源: 题型:
食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A. 步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C. 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D. 步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物.
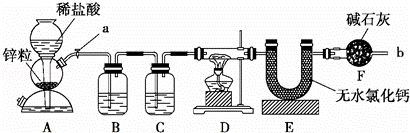
(1)如何检查装置A的气密性?
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须 .
(4)装置B的作用是 ;装置C中装的液体是 .
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是
(6)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为 g.
(7)U形管E右边又连接干燥管F的目的是 ,若无干燥管F,测得Fe2O3的质量将 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中 ,与100 ml
,与100 ml  0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、1 00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
C、50  ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com