
分析 (1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol,依据盖斯定律计算;
(3)其产物无毒无污染;
(4)1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量,则辛烷的燃烧热是5518kJ/mol;
(5)$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,根据甲烷和反应热之间的关系式计算.
解答 解:(1)解:反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为$\frac{256.7kJ}{0.4mol}$=641.75kJ,
所以反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75kJ/mol:则16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol;与液态双氧水反应生成液态水时放出的热量408.875kJ,
故答案为:408.875;
(3)其产物无毒无污染,不影响环境,故答案为:产物无污染;
(4)1mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518kJ热量,则辛烷的燃烧热是5518kJ/mol,其热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H==-5518 kJ•mol-1,
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H==-5518 kJ•mol-1;
(5)$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,标准状况下4.48LCH4其物质的量为0.2mol,则放出的热量为0.2mol×867kJ=173.4kJ,
故答案为:173.4.
点评 本题考查反应热的有关计算,为高频考点,侧重考查学生分析计算能力,明确盖斯定律的灵活运用、正确书写目标方程式是解本题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别直馏汽油与裂化汽油 | |
| B. | 用溴水鉴别苯、甲苯 | |
| C. | 用燃烧方法鉴别聚乙烯、聚氯乙烯 | |
| D. | 用溴水鉴别苯、硝基苯和苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
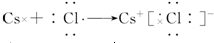 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
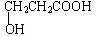 ;若甲能发生银镜反应,则甲的结构简式为
;若甲能发生银镜反应,则甲的结构简式为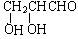 .
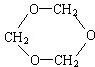
.
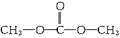 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:ra>rb>rc | B. | 微粒半径:Bn->An+ | ||
| C. | C元素不一定是稀有气体元素 | D. | 原子序数:C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
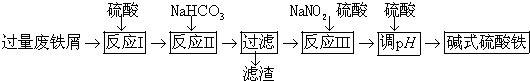
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com