
| 滴定次数 实验数据(mL) | 1 | 2 | 3 |
| V(样品) | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 14.95 | 15.05 |
| c(标注)×V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
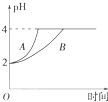 请回答下列问题:
请回答下列问题:| 温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 意大利罗马大学的Fuluio Cacace等人获得了极具有理论研究意义的气态N分子,其分子结构如图所示,已知断裂1molN-N吸收167KJ的热量,生成1molN≡N放出942KJ热量,根据上述信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fuluio Cacace等人获得了极具有理论研究意义的气态N分子,其分子结构如图所示,已知断裂1molN-N吸收167KJ的热量,生成1molN≡N放出942KJ热量,根据上述信息和数据,判断下列说法正确的是( )| A、N4属于一种新型化合物 |
| B、N4晶体熔点高,硬度大 |
| C、相同质量的N4的能量高于N2 |
| D、1molN4转变为N2将吸收882KJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CO2有氧化性 | 点燃的Mg条能在CO2中继续燃烧 |
| B | KNO3的溶解度大 | 可用重结晶法除去KNO3中的NaCl |
| C | Cl2可部分与水反应 | 用排饱和食盐水的法收集Cl2 |
| D | Al3+ 易水解 | 不能用蒸干AlCl3溶液的方法制得AlCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、NO3-、SO42- |
| B、Ba2+、K+、Cl-、SO42- |
| C、Fe2+、Na+、Cl-、NO3- |
| D、K+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6mol/L |
| B、9.2mol/L |
| C、10.8mol/L |
| D、5.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
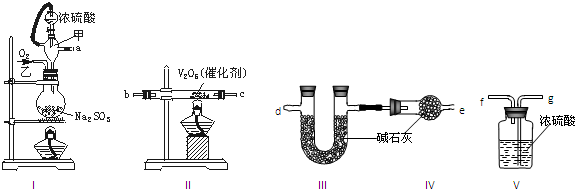
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com