
 已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.| c2(H+) |
| c(Cu2+) |
| c2(H+)×c2(OH-) |
| c(Cu2+)×c2(OH-) |
| Kw2 |
| Ksp |
| (10-14)2 |
| 2.0×10-20 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
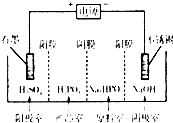
 (2011?绵阳模拟)某化学兴趣小组为探究
(2011?绵阳模拟)某化学兴趣小组为探究
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省黄冈市高三4月调研考试理综化学试卷(解析版) 题型:实验题
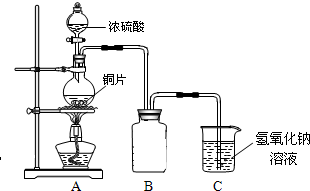
某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告:

(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____ ,剩余固体总质量为 g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____ mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____
。已知KsP[Cu(OH)2]=2.2×l0-20,1g  =0.7)
=0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究
某化学兴趣小组为探究查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com