
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是( )
A.由反应可知,氧气、氯气均为氧化产物
B.若化学计量数a=8,则该反应转移电子数为12e-
C.若b确定,则方程式中其他物质的化学计量数均能确定
D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O
科目:高中化学 来源:2014年高考化学苏教版总复习 11-2 有机物的结构分类和命名练习卷(解析版) 题型:选择题
下列烷烃的分子式可以表示3种不同结构的是( )
A.C5H12 B.C4H10 C.C3H8 D.C2H6
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-3 常见气体的制备练习卷(解析版) 题型:选择题
可用如图所示装置制取、净化、收集的气体是( )
A.锌和稀硝酸反应制一氧化氮
B.亚硫酸钠与浓硫酸反应制二氧化硫
C.铁和稀硫酸反应制氢气
D.浓氨水和生石灰反应制取氨气
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
取少量无机盐溶液,对其中的离子进行检验。下列判断正确的是( )
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+
D.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(解析版) 题型:选择题
古代曾用绿矾加强热得到硫酸、红色粉末和有刺激性气味的气体,此反应属于( )
A.有氧化还原的分解反应
B.无氧化还原的分解反应
C.只是氧化还原反应
D.只是分解反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(解析版) 题型:填空题
制备Cl2需用8mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
(1)需要用量筒量取12 mol·L-1的盐酸的体积为 mL;
(2)实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.100mL烧杯 H.100mL容量瓶
(3)下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:实验题
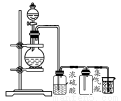
测定1 mol氧气在标准状况下所占体积的实验操作步骤如下:
①按下图装配实验装置。
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置放置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口,一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:填空题
2013年1月26日15时整,中国国产大型军用运输机运-20成功降落。标志着运-20首飞圆满成功。请回答下列问题:
Ⅰ.运-20根据结构和性能要求不同,使用的材料也不同,你认为下列材料中用于运-20制造,合理的是 (填序号)。
A.利用纯铝制造运-20发动机
B.用镁铝合金制造运-20座椅
C.用氧化铝制造运-20电器线路的导线
D.用普通钢制造运-20灭火器的外壳
Ⅱ.制造铝合金所需的铝从铝土矿中提取,已知铝土矿的主要成分为氧化铝(含有Fe2O3、SiO2杂质),SiO2不与盐酸反应但能溶解在NaOH溶液中生成可溶性Na2SiO3。工业上经过下列工艺可以冶炼金属铝:
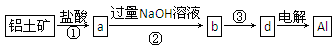
(1)①②中除加试剂外,还需要进行的操作是 。
(2)写出步骤②反应的化学方程式: 。
(3)③中需要通人过量的二氧化碳,写出该过程中含铝化合物发生反应的离子方程式: 。
(4)一种新型镁铝合金的化学式为Mg17Al12,科学家发现它具有储氢性能,是一种潜在的储氢材料,可在氩气保护下,将一定比例的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。
①制备镁铝合金(Mg17Al12)时通人氩气的目的是 。
②在5.0 mol·L-1盐酸中,混合物Y能完全释放出H2。1 mol Mg17A112完全吸氢后得到的混合物Y与上述盐酸完全反应,消耗盐酸的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com