
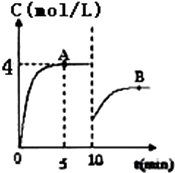
 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.分析 (1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,根据v=$\frac{△c}{△t}$计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
根据三段式计算平衡时各组分的浓度,代入平衡常数k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$计算;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)若合成塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式;
(4)反应达平衡后,再充入一定量的氮气和氢气,增加反应物浓度平衡向正反应方向移动,平衡常数只受温度影响,当温度不变时,平衡常数不变;
解答 解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH3)=$\frac{4mol/L}{5min}$=0.8mol/(L•min),速率之比等于化学计量数之比,
故v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.8mol/(L•min)=1.2mol/(L•min),
N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$=$\frac{4{\;}^{2}}{(a-2)(b-6){\;}^{3}}$=$\frac{16}{(a-2)(b-6){\;}^{3}}$;
故答案为:1.2mol/(L•min);$\frac{16}{(a-2)(b-6){\;}^{3}}$;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol;
故答案为:N2(g)+3H2?2NH3(g)△H=-91KJ/mol;
(4)反应达平衡后,再充入一定量的氮气和氢气,增加反应物浓度平衡向正反应方向移动,平衡常数只受温度影响,所以充入一定量的氮气和氢气,平衡常数不变,
故答案为:正反应方向; 不变;
点评 本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 纤维素从化学成分看,它是一种多糖.食物中的纤维素不仅能为人体提供能量,也能促进肠道蠕动、吸附排出有害物质 | |
| B. | 某物质的结构为 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 | |
| C. | 蛋白质的检验方法有许多种,而与双缩脲试剂作用而产生紫玫瑰色的颜色反应是最常见的方法之一 | |
| D. | 糖类、油脂、蛋白质是人类最主要的能量来源,它们都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 这是一个电解池 | |
| B. | C作阴极,Cu作阳极 | |
| C. | 电解的过程实际上是电解水 | |
| D. | 石墨电极上的反应是4OH--4e-=O2↑+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
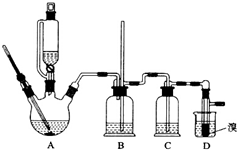 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 蔗糖 | 硫酸钾 | 阿司匹林 | 高锰酸钾 | 硝酸银 |
| 质量(g) | 25.00 | 0.174 | 0.17 | 0.316 | 0.340 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com