
【题目】当前煤炭在我国的能源消费中占60%以上,它在给我们提供廉价能源的同时,燃烧生成的SO2、NOx等也造成了比较严重的大气污染问题。
(1)向燃煤中加入CaO,煤中硫元素大多数会转化为CaSO4,故CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
③CaCO3(s)=CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)=2CuSO4(s) △H =________kJ·mol-1。
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2,相应量的煤在相同条件下燃烧时向环境释放出的热量会减少______________kJ。
(2)活性炭对NO2有较强的吸附性,二者之间可发生2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
i.固定密闭容器的体积为5L,测得恒容时不同温度下NO2的转化率(ɑ)与时间(t)的关系如图1所示:

①该反应的△H_________0填“>”或“<”),温度为T2时,反应开始到达到平衡的时间段内v(N2)=_____________。
②温度为T1时该反应的平衡常数K=________,若保持温度不变,提高NO2转化率的方法是___________。
ⅱ.保持容器中的温度恒定,测得20s时,CO2的体积分数(φ)与压强(p)的关系如图Ⅱ所示。

③图Ⅱ曲线呈现先增后减的变化趋势,其原因为______________________,压强为p1时,第20s时容器中c(NO2):c(N2)=_______________。
(3)常温下,用NaOH溶液吸收SO2既可消除大气的污染,又可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶被的pH=____________(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7)。
【答案】 -1038.2 356.4 < 0.016mol·L-1·s-1 0.27 分离出生成物 b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行 2:1 9
【解析】(1)考查热化学反应方程式的计算,根据目标方程式,①×2+②得出2SO2(g)+O2(g)+2CaO(s)=2CuSO4(s) △H=(-402×2-234.2)kJ·mol-1=-1038.2kJ·mol-1;固定2molSO2,需要消耗2molCaO,因此需分解2CaCO3,少向环境释放的热量为2×178.2kJ=356.4kJ;(2)考查勒夏特列原理、化学反应速率的计算、化学平衡的计算,①根据图1,T1显达到平衡,说明T1>T2,根据勒夏特列原理,升高温度,NO2的转化率降低,即升高温度向逆反应方向进行,△H<0;T2时,NO2的转化率为0.8,即达到平衡消耗的NO2的物质的量为2×0.8mol=1.6mol,根据化学反应速率的数学表达式v(NO2)=1.6/(5×10)mol/(L·s)=0.032mol/(L·s),根据化学反应速率之比等于化学计量数之比,即v(N2)=v(NO2)/2=0.032/2mol/(L·s)=0.016mol/(L·s);②2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始: 2 0 0
变化: 1.2 0.6 1.2
平衡: 0.8 0.6 1.2
根据化学平衡常数的定义:K= =0.27;提高NO2的转化率,可以采取分离出生成物,降低压强等方法;③b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行;由方程式可知,当CO2的体积分数为40%时,N2占20%,NO2占40%,因此c(NO2):c(N2)=2:1;(3)
=0.27;提高NO2的转化率,可以采取分离出生成物,降低压强等方法;③b点前反应未达到平衡状态,压强增大,反应速率加快,CO2含量升高;b点后反应处于平衡状态,压强越大,越不利于反应向右进行;由方程式可知,当CO2的体积分数为40%时,N2占20%,NO2占40%,因此c(NO2):c(N2)=2:1;(3) ,解得c(H+)=10-9mol·L-1,即pH=9。
,解得c(H+)=10-9mol·L-1,即pH=9。


科目:高中化学 来源: 题型:
【题目】m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
A. 沉淀中OH-的质量为(n-m)g
B. 恰好溶解后溶液中的NO的物质的量为aVmol
C. 反应过程中转移的电子的物质的量为![]() mol
mol
D. 与合金反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2氯丙烷制取少量的1,2丙二醇经过下列哪几步反应( )
A. 加成→消去→取代 B. 消去→加成→水解
C. 取代→消去→加成 D. 消去→水解→加成消
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436 | 243 | 431 |
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转换率α(H2)=___________。
②若反应CO2+3H2![]() CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________(填字母)。
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
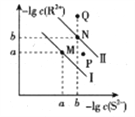
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() (a).
(a). ![]() (b).
(b). ![]() (c)的分式均为C5H6,下列有关叙述正确的是
(c)的分式均为C5H6,下列有关叙述正确的是
A. 符合分子式为C5H6的同分异构体只有a、b、c三种
B. a、b、c的一氯代物都只有三种
C. a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D. a、b、c分子中的5个碳原子一定都处于同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定浓度的下列溶液,不外加任何试剂就能依次鉴别出来,正确的鉴别顺序为( ) ①NaOH溶液②(NH4)2SO4溶液③BaCl2溶液④KNO3溶液⑤FeCl3溶液.
A.①②③④⑤
B.②③⑤④①
C.⑤①②③④
D.⑤③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是( )
A.由图①所示实验可得出三种元素的非金属性强弱顺序是:氯>碳>硅
B.图②可用于干燥、收集氯化氢,并吸收多余的氯化氢
C.图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的△H>0
D.对反应:A(s)+2B(g)xC(g),根据图④可以求出x=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3—CH=CHCl能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使酸性KMnO4溶液褪色 ⑤与AgNO3溶液反应生成白色沉淀 ⑥聚合反应
A. 以上反应均能发生 B. 只有⑥不能发生 C. 只有⑤不能发生 D. 只有②不能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com