
下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向做完淀粉水解后的溶液中直接加入新制的Cu(OH)2,并加热 | 检验淀粉是否水解 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2是否变质 |
A
解析试题分析:盐酸的酸性比碳酸强,则碳酸氢钠与氯化氢能反应,生成氯化钠、水和二氧化碳气体,二氧化碳不溶于饱和碳酸氢钠,故A正确;Ag是金属活动顺序表中氢后的不活泼金属,不溶于非氧化性酸和碱,能溶于硝酸,一般用稀硝酸溶解,反应生成硝酸银、一氧化氮和水,故B错误;淀粉在酸催化下水解的最终产物是葡萄糖,葡萄糖在碱性条件下与新制氢氧化铜共热,能反应生成砖红色沉淀,因此水解液中应该先加入氢氧化钠溶液调溶液pH至碱性,再加入少量新制氢氧化铜,加热3-5分钟,若产生砖红色沉淀,说明淀粉已经水解,故C错误;硝酸能使亚铁离子氧化为铁离子,干扰检验,因此不能加稀硝酸酸化,应直接加入硫氰化钾溶液检验,若溶液变红,说明氯化亚铁溶液已经变质,故D正确。
考点:考查化学实验方案的设计与评价,涉及洗气除杂质、溶解银、淀粉是否水解、亚铁离子是否被氧化等。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:单选题
下列根据实验操作和现象所得出的结论或相应的解释错误的是
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol?L-1 Fe(NO3)2溶液的试管中加入0.5mol?L-1 H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol?L-1 KI溶液 | 出现黄色沉淀 | 说明 PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol?L-1 CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
| D | 用1mol?L-1醋酸溶液和1mol?L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(双选)下列实验方法正确的是
| A.用无水乙醇提取碘水中的碘单质 |
| B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- |
| C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 |
| D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀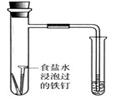 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油。
资料一 石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态。
资料二 石油催化裂化中通常使用Al2O3作催化剂。
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
(1)该装置仪器连接的顺序应遵循的原则为__________________,
为保证实验成功,实验前必须进行的操作是_________________,
装置中较长导管的作用是_____________________。
(2)试管Ⅱ中少量液体凝结说明了______。
(3)试管Ⅲ中溶液褪色说明了________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是_______________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式________________。
(6)石油裂化的重要意义是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B.Ⅲ装置后缺少干燥装置 |
| C.Ⅱ装置中玻璃管内有水冷凝 |
| D.CuO没有全部被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com