
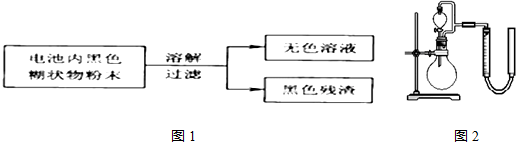
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
分析 (1)锌锰干电池的负极上Zn失去电子,负极消耗1mol时转移2mol电子,NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气;
(2)Zn(OH)2是两性氢氧化物,能溶解在NaOH溶液中,无色溶液中含Zn2+、NH4+,加碱均发生反应;
(3)等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一、二中参加反应的H2O2的物质的量相同;实验二中反应生成锰离子、水、氧气.
解答 解:(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,负极消耗1mol时转移2mol电子,每通过0.2mole-,负极质量减少0.1mol×65g/mol=6.5g,由NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,正极反应为2NH4++2e-═2NH3↑+H2↑,
故答案为:6.5;2NH4++2e-═2NH3↑+H2↑;
(2)①无色溶液中含Zn2+、NH4+,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 白色沉淀逐渐溶解,产生刺激性气味的气体 | 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
点评 本题考查较为综合,涉及原电池、离子反应、氧化还原反应及实验设计,明确习题中的信息及物质的性质即可解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
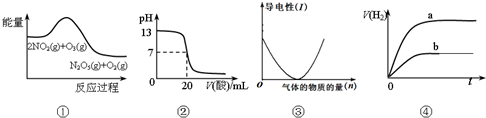
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入醋酸体积的变化 | |
| C. | ③可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都可以从煤焦油中获得 | |
| B. | 乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 | |
| C. | 乙烯和苯都能使溴水褪色,且褪色的原因相同 | |
| D. | 乙烯和苯都能与H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸可以发生取代反应 | |
| B. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯酸与HBr发生加成反应只能得到唯一产物 | |
| D. | 丙烯酸钠溶液中Na+浓度大于丙烯酸根离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com