
ij��֪A��B���������ֶ�����Ԫ����ɵĻ����A��ijԪ�ص���������Ϊ25%��B����ɫ��Ӧ�ʻ�ɫ��C��J��X��ͬ���ڵ�Ԫ�صļ��⻯�XΪ��ɫҺ�壬C��JΪ���壬D��һ�ֲ�����ˮ�İ�ɫ���塣��Ӧ���ɵ�ˮ������ȥ������������ͼ��ʾ�Ĺ�ϵ��
��1��д����ѧʽ��A_________,E____________,L___________
��2���ڷ�Ӧ�٢ڢۢܢ�������������ԭ��Ӧ����_____________________________
��3����Ӧ�ۻ�ѧ����ʽΪ��_______________________________________________
��4��д���������ӷ���ʽ����Ӧ��_________________________________________��
G��Һ��M��Һ�ķ�Ӧ______________________________________________��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Z��������Ԫ�أ���֪X����Y��������ͬ���Ӳ�ṹ��ZԪ��ԭ�Ӻ˵������YԪ��ԭ�Ӻ˵������9��Y����һ�������¿ɱ�������YZ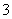 ��������˵����ȷ����
��������˵����ȷ����
A��X��Y��Z�����ڶ�����Ԫ�� B�����Ӱ뾶X��>Y��
C��Y����̬�⻯����γ����
D��X��Y��Z����Ԫ����ɵĻ������мȺ������Ӽ��ֺ��й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ������ȷ����
A.��ϩ�Ľṹ��ʽ��CH2CH2
B.��Ȳ�ķ���ʽ��C2H2
C.˳-2-��ϩ�Ľṹ��ʽ��H3CHHCH3
D.�����ʵ��ʽ��C2H4O2
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)��֪ij�¶�ʱ0.01 mol/L NaOH��Һ��pH��10������¶���ˮ�����ӻ�����Kw��1.0��10��12�����¶��½�pH��12��NaOH��ҺV1 L��pH��1��H2SO4��ҺV2 L��ϣ������û����Һ��pH��10����V1��V2Ϊ����������
(2)�����£�ȡpH��2������ʹ�����Һ��100 mL�������зֱ����������Zn������Ӧ����ʱ����Һ��pH��Ϊ4���������м����Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1����m2(ѡ�����������������)��
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���


ͼ1 ͼ2 ͼ3 ͼ4
A����ͼ1��ʾװ�ó�ȥCl2�к��е�����HCl
B����ͼ2��ʾװ������NH4Cl������Һ�Ʊ�NH4Cl����
C����ͼ3��ʾװ����ȡ����������CO2����
D����ͼ4��ʾװ�÷���CCl4��ȡ��ˮ���ѷֲ���л����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧʵ���С�����������˵������ȷ����( )
�ٷ�Һʱ������Һ©���Ͽ����ӣ���������Һ©������
�ڼ�������غͶ������̵Ļ�����Ʊ�����������ˮ���ռ���������Ƴ����������ƾ��Ƣ���ȡ����ʱ�������װ����������װҩƷ
�ܵ�ȼ��ȼ��������H2��CO��ʱ�����������崿������ȼ
����H2��ԭCuOʵ��ʱ����ͨH2������CuO����Ӧ��Ϻ������ƾ��ƴ��Թ���ȴ��ֹͣͨH2
��ʹ��������ƽ������������ʱ������������С�����룬���������ϴ������
A���٢ڢۢ� B���٢ڢܢݢ� C���٢ڢۢܢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڷ�Ӧ3S+6KOH ���� K2SO3+2K2S+3H2O�У���ԭ���������������ʵ�����Ϊ( )
A��1 ��1 B��2 ��1 C��1 ��2 D��3 ��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
˫�ǻ���̼������ҽ���ϳ��õ�һ����������仯ѧʽ��NaAl��OH��2CO �����ڸ����ʵ�˵����ȷ����( )
�����ڸ����ʵ�˵����ȷ����( )
A. ���������������������� B. ��������Al��OH��3��Na2CO3�Ļ����
C. 1 mol NaAl��OH��2CO3��������3 mol H D. ��ҩ�����ʺ���θ�����߷���
D. ��ҩ�����ʺ���θ�����߷���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ�ͨ�����з�Ӧ�����Ʊ��״���
 CO ( g ) + 2H2 ( g )
CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H ��-90.8 kJ·mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯����ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H ��-90.8 kJ·mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯����ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ �� ��
��2���練Ӧ��ʼʱ�Գ���10mol CO ��20mol H2������ƽ��״̬Bʱ���������V��B��= �� L��
��3�����ڷ�ӦCO(g)+2H2(g) CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� �� ������ĸ����
CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� �� ������ĸ����
A��CO�ĺ������ֲ��� B��������CH3OHŨ����COŨ�����
C��2V����CH3OH��=V����H2��D�������л�������ƽ����Է����������ֲ���
��4��CO(g)+2H2(g) CH3OH(g)��������ͬ�����ʵ���
CH3OH(g)��������ͬ�����ʵ���
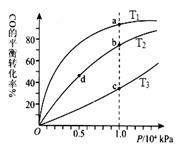 Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ��
Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ��
��ϵ����ͼ��ʾ������˵����ȷ���� ��
A���¶ȣ�T1 < T2 <T3
B������Ӧ���ʣ��ͣ�a��>�ͣ�c���� �ͣ�b��>�ͣ�d��
C��ƽ�ⳣ���� K(a) =K(c) �� K(b) >K(d)
D��ƽ��Ħ��������M(a)<M(c)�� M(b)>M(d)
��5����֪CO2��g��+H2��g�� CO��g��+H2O��g�� ��H= + 41.3 kJ·mol��1 ����д����
CO��g��+H2O��g�� ��H= + 41.3 kJ·mol��1 ����д����
CO2��H2��ȡ�״����Ȼ�ѧ����ʽ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com