


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
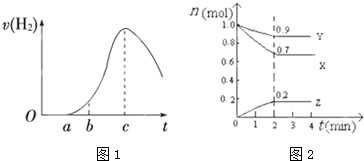
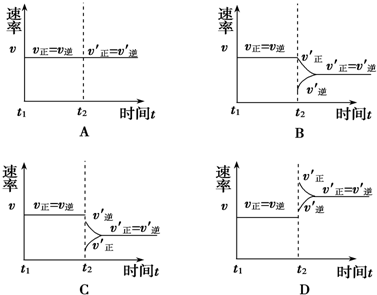
查看答案和解析>>
科目:高中化学 来源: 题型:
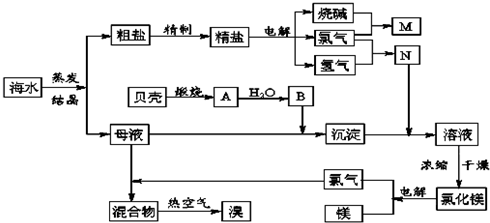
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
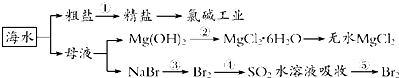
| A、工段③④⑤是溴元素的富集过程,③④⑤中均发生了氧化还原反应 |
| B、工段②中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、氯碱工业通过电解NaCl溶液,主要生产Cl2、H2和纯碱 |
| D、工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作顺序为:加入足量BaCl2溶液→加入足量NaOH溶液→加入足量Na2CO3溶液→加入足量盐酸→过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25g | B、16g |
| C、9g | D、22.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com