
【题目】由下列物质构成的物质中,同时存在极性键、非极性键和氢键的是 ( )
A.CO2B.H2O2C.H2OD.C2H2
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:

(1)装置A中反应的化学方程式为_____。
(2)设计实验:利用装置A中产生的气体证明+4价硫具有氧化性:_____。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、C、__、__、D、F,其中装置C的作用是_____,通过___________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A残液中SO2的含量。量取 1mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2=H2SO4),然后用0.1000mol/LNaOH标准溶液进行滴定,至终点时消耗NaOH溶20.00mL。

①G中球形冷凝管的冷凝水进口为_____(填“a”或“b”)。
②残液中SO2含量为____g/L。
③经多次测定发现,测定值始终高于实际值,则其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的CO、NO、NO2、SO2都能使人中毒,其中易与人体中的血红蛋白结合,使血红蛋白失去运载O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习中经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2气体 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 锌粒放入硫酸亚铁溶液中 Zn+Fe2+=Zn2++Fe | 钠投入硫酸铜溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )
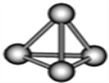
A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有A、B、X、Y、Z五种短周期元素,原子序数依次增大。它们的性质或原子结构如下表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含量最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素 |
Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
①X元素在元素周期表中的位置是______________;
②Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为___________________________________________________;
③化合物甲由A和B两种元素组成且质量比为3:14,甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示
X | ||
Y | ||
Z |
①X元素单质的化学式是_________,若X核内中子数与质子数相等,则X单质的摩尔质量为________;
②Y单质的电子式是_________;Z与钙形成的化合物的电子式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com