
| A、钠与冷水剧烈反应而镁与冷水很难反应 | B、氢氧化铝具有两性而硅酸只具有弱酸性 | C、氯气和氢气在光照条件下反应而硫和氢气在加热条件下才能反应 | D、硫化氢水溶液呈弱酸性而氯化氢水溶液呈强酸性 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
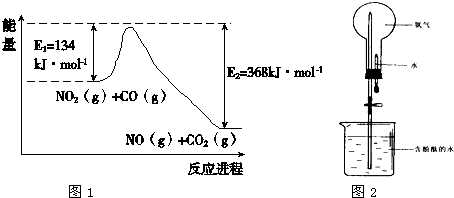
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
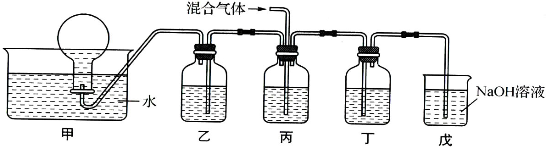
查看答案和解析>>
科目:高中化学 来源: 题型:
请指出下列分子的结构中不能满足8电子稳定结构的是:______________________________
________________________________________________________________。
(CO2、PCl3、PF5、CCl4、NO、CO、N2O3、N2O5、HClO、COCl2(光气)、SF6、XeF2、BF3、BeBr2、N2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com