
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
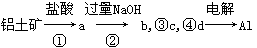
下列说法中错误的是( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
A、B、C、D四种短周期元素,原子序数依次增大而原子半径依次减小。A、B、D三种元素的最高价氧化物对应的水化物都能相互发生反应。B、C两原子的最外层电子数之和与D原子的最外层电子数相等。则下列说法中不正确的是( )
A.四种元素都是第三周期的元素
B.工业上常用石灰乳吸收D的单质制取漂白粉
C.A、D两元素形成的化合物是A元素在自然界中的最主要存在形式
D.C元素的单质称为硅石,是制作光缆的主要材料
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
符合图中阴影部分的物质是( )
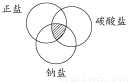
A.Na2CO3 B.Cu2(OH)2CO3 C.NaCl D.NaHCO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
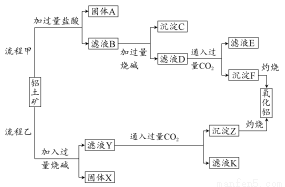
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中溶质的主要成分是 (填化学式),写出该溶质的一种用途: 。
(5)已在298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)= 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:选择题
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量
D.甲中酸过量、乙中碱过量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:实验题
“厨房化学”可以理解为利用家庭生活用品来做化学实验,对化学进行学习和研究的活动。某厨房内有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
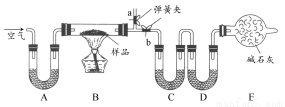
(1)实验时,B中发生的反应的化学方程式为 。
(2)装置C、D中盛放的试剂分别为:C ,D 。(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是 ,它在该实验中的主要作用是 。
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
根据海水综合利用的工业流程图(如图),判断下列说法正确的是( )
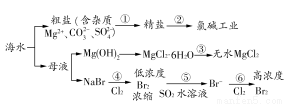
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br-,需消耗2.24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。
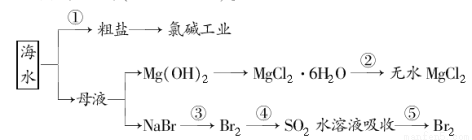
下列有关说法不正确的是( )
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-3 分子空间结构与物质性质练习卷(解析版) 题型:填空题
乙炔是有机合成工业的一种原料,工业上曾用CaC2与水反应制备乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O中含有的π键数目为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
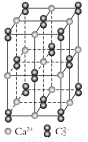
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com