
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
【答案】B
【解析】试题分析: 依据化学平衡的三段式列式;半分钟后,C的物质的量增加了0.30mol;
4A(g)+5B(g)═4C(g)+6D(g)
起始量(mol) x y 0 0
变化量(mol) 0.3 0.375 0.3 0.45
平衡量(mol) x-0.3 y-0.375 0.3 0.45
A、A的平均反应速率=" 0.3/5/30=0.0020" molL-1s-1,A错误;
B、起始量不定,容器中含D物质的量至少为0.45 mol,B正确;
C、起始量不知,容器中A、B、C、D的物质的量的比不一定是4:5:4:6,故C错误;
D、容器中A的物质的量一定减少了0.30 mol,故D错误;


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 9gD2O中含有的电子数为5NA
B. 氢氧化铁胶体带正电荷。用含0.1mol的FeCl3溶液制成的氢氧化铁胶体中,胶粒数小于0.1NA
C. 常温下,7.8gNa2O2与100mL0.05mol/L的HCl溶液反应,产生的气体体积大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物质的量之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。
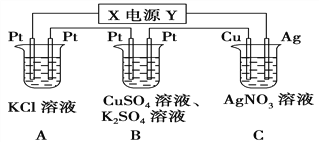
(1)电源电极X的名称为________;
(2)A中发生的离子方程式为_______________________
(3)B中阳极的电极反应式为___________________________
(4)pH变化:A_______,B_______,C_______。(填“增大”“减小”或“不变”)
(5)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为______________(设电解前后溶液体积无变化)。
(6)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为_______(设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“高铁出口”是中国的骄傲,高铁产业的发展也给铝工业带来了春天。最近,某大学的超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是
A.属于金属元素B.中子数与质子数之差为29
C.原子的核外电子数为13D.27Al和42Al是两种不同的核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
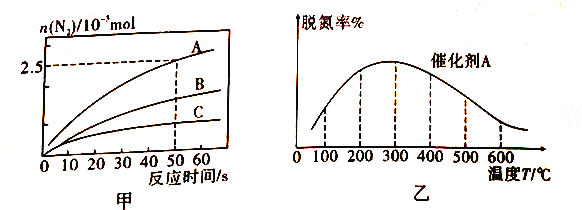
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
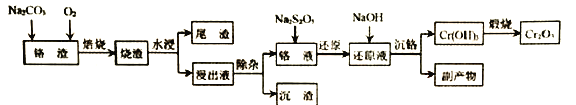
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
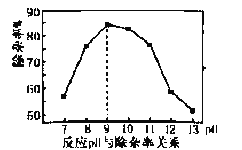
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在恒容密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
2E(g),若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
A. 20% B. 40% C. 60% D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com