
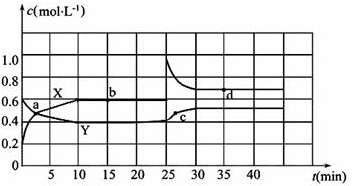
分析 (1)根据反应方程式2NO2(g)?N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此结合图象中物质浓度的变化量判断;
物质的浓度不发生变化时表示化学反应处于平衡状态,根据图象判断处于平衡状态的点;容器内混合气体的体积不变,质量不变所以密度不变;
(2)①根据v=$\frac{△c}{△t}$计算v(NO2);
②0~15min,根据图象求出平衡时的浓度,再根据K的表达式求出K;
③由曲线看出25 min时,NO2的浓度突然增大;温度不变,化学平衡常数不变;
(3)由曲线看出25 min时,NO2的浓度突然增大;根据压强对平衡的影响分析.
解答 解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,10-25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态,
故答案为:X;b和d;
(2)①X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=$\frac{0.4mol/L}{10min}$=0.04mol•L-1•min-1,
故答案为:0.04;
②0~15min,反应2NO2(g)?N2O4(g),v(NO2)=0.6mol•L-1,v(N2O4)=0.4mol•L-1,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.4}{0.{6}^{2}}$=$\frac{10}{9}$,
故答案为:$\frac{10}{9}$;
③由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;温度不变,化学平衡常数不变;
故答案为:=;
(3)因在25 min时,增大了NO2的浓度,相当于增大了压强,平衡右移,d点时NO2的百分含量小于b时NO2百分含量,要使25 min时改变条件达到使NO2(g)的百分含量与d点相同的化学平衡状态,可加压,加入一定量的N2O4,也相当于加压,
故答案为:增大NO2的浓度;BD.
点评 本题考查化学平衡的计算,为高考常见题型,涉及化学平衡图象、反应速率计算等知识,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学平衡常数、化学反应速率的概念及计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-分别都不能大量共存(常温下) | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+; pH=2的溶液:NO3-、Fe2+、Na+、Al3+分别都可以大量共存(常温下) | |
| C. | 已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的KSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | |
| D. | 表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
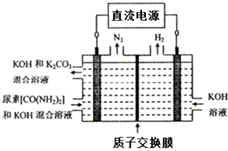 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
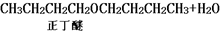
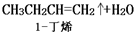
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
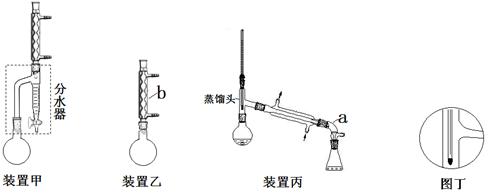


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
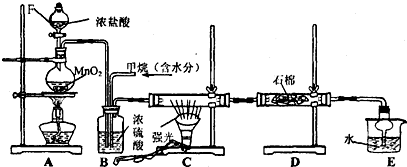
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com