
| A. | N2的转化率为28.57% | B. | H2的转化率为85.7% | ||
| C. | N2的体积分数为20% | D. | H2的体积分数为10% |
分析 设N2和H2的起始物质的量均为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):x x 0
变化量(mol):a 3a 2a
平衡量(mol):x-a x-3a 2a
所以$\frac{2a}{2x-2a}$=40%,整理可得7a=2x,据此解答.
解答 解:设N2和H2的起始物质的量均为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):x x 0
变化量(mol):a 3a 2a
平衡量(mol):x-a x-3a 2a
所以$\frac{2a}{2x-2a}$=40%,整理可得7a=2x,令a=2,x=7,
A.N2的转化率为$\frac{2}{7}$×100%=28.57%,故A正确;
B.H2的转化率为$\frac{6}{7}$×100%=85.7%,故B正确;
C.N2的体积分数为$\frac{7-2}{14-4}$×100%=50%,故C错误;
D.H2的体积分数为$\frac{7-6}{10}$×100%=10%,故D正确,
故选:C.
点评 本题考查化学平衡计算,难度不大,注意三段式在化学平衡计算中应用,侧重考查学生分析计算能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含分子数为NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 常温常压下,17g NH3含电子数目为10NA | |
| D. | 2.7g金属铝变成铝离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3和NaHCO3溶液中离子种类相同 | |
| B. | 在溶质物质的量浓度和体积相等的Na2A和NaHA溶液中,阴离子总数相等 | |
| C. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2 c(CO32-) | |
| D. | 在Na2CO3溶液中一定有:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
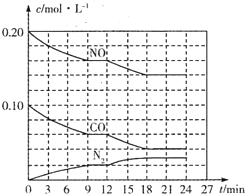 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com