
| A. | HCl的电子式: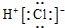 | B. | CO2分子的结构式:O=C=O | ||
| C. | Na的原子结构示意图: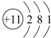 | D. | 钙离子的电子式:Ca2+ |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.二氧化碳为直线型结构,分子中含有2个碳氧双键;
C.钠原子的核电荷数=核外电子总数=11,最外层含有1个电子;
D.钙离子为阳离子,直接用离子符号表示电子式.
解答 解:A.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B.二氧化碳分子中含有2个碳氧双键,其结构式为:O=C=O,故B正确;
C.Na原子的核电荷数、核外电子总数都是11,其原子结构示意图为: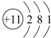 ,故C正确;
,故C正确;
D.钙离子为简单阳离子,用离子符号表示其电子式,则钙离子的电子式为Ca2+,故D正确;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
 ,⑤的电子式是
,⑤的电子式是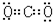 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | H2很难与砹化合 | D. | HAt比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④② | B. | ①③②④ | C. | ③④②① | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃是难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生消去反应 | |
| C. | 所有卤代烃都含有卤素原子 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
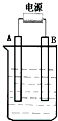 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.
(1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
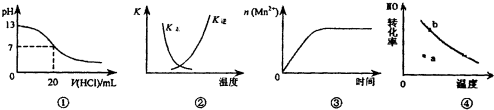
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0,1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g):△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④曲线表示2NO+O2?2NO2中NO的最大转化率与温度的关系,a点表示未达到平衡状态,且v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
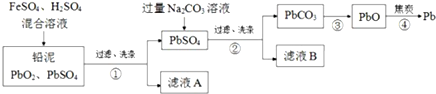
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com