
用离子方程式实现下列转化:Fe2+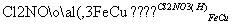 Fe3+
Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
由—H、—CH3、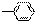 、—OH、—COOH五种原子或与原子团中的任意两种,两两组合形成的物质中,属于弱电解质的有机物有( )
、—OH、—COOH五种原子或与原子团中的任意两种,两两组合形成的物质中,属于弱电解质的有机物有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与B形成可使红色石蕊试纸变蓝的气体,A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成三角锥型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是 ( )
A.离子半径:D+>E->C2->A+
B、A与B形成的物质,每个原子最外层都满足稀有气体稳定结构的分子只有BA3
C.C、D、E形成的化合物溶于水可呈弱碱性
D.B、C的简单氢化物形成的化合物前者稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
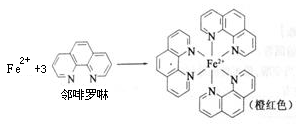
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:4FeCl3+2NH2OH·HCl=4FeCl2+N2O+6HCl+H2O
①Fe3+在基态时,核外电子排布式 。
 ②羟胺(NH2OH)中O采用 杂化。
②羟胺(NH2OH)中O采用 杂化。
③Fe2+与邻啡罗啉形成的配合物中,配体数为 。
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,该晶体中含有的化学键类型是 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
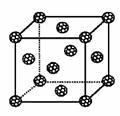
(4)现把C60抽象成质点,该晶体的晶胞结构如右图所示,如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。若C60的半径为apm,则掺杂C60化合物密度为 g/cm3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
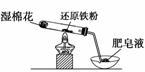
(1)实验中使用肥皂液的作用是_________________________________________。
(2)某同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。
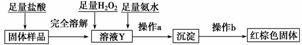
确定是否存在Fe3O4需要测定并记录的实验数据是______________________________
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是 ( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
利用相关数据作出的推理或判断一定正确的是:
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质的熔沸点数据推断物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变数据判断反应能否自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
工业[b16] 上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
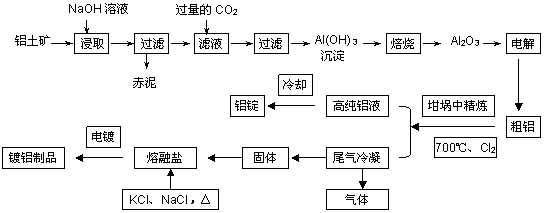 |
(1)向滤液中通入过量CO2所发生反应的离子方程式为 ▲ 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 ▲ 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有___▲___。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在____▲____。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为____▲_________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是____▲_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com