
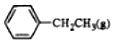
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$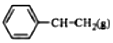 +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钠可用于配制生理盐水 | |
| B. | 二氧化硅可用于制造玻璃 | |
| C. | 海水中的钠元素以单质存在 | |
| D. | 氧化镁(熔点2800℃)是良好的耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3 | B. | Cu(OH)2 | C. | Mg(OH)2 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40gNaOH的稀溶液与足量稀醋酸完全中和放出的热量小于57.3kJ | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,此反应的△H变为-46.2kJ•mol-1 | |
| C. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ•mol-1,则氢气燃烧热为285.8kJ/mol | |
| D. | 已知S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
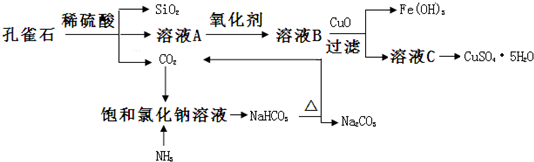
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com