
 2NH3
2NH3 ,解得 x=0.5。
,解得 x=0.5。 ×100%=25%。
×100%=25%。 2NH2
2NH2 x[即反应前后,体系缩小体积为(
x[即反应前后,体系缩小体积为( )-x=x]
)-x=x] x
x  x
x ×100%=25%,
×100%=25%, ,即反应后缩小的气体体积与原反应物气体体积之比为1∶5。
,即反应后缩小的气体体积与原反应物气体体积之比为1∶5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题

 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。 (2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。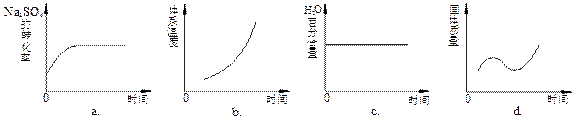
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵值增大的反应都是混乱度增大的反应 |
| D.熵值增大的反应都能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)达到平衡标志的是( )
2C(g)达到平衡标志的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点比生铁低 |
| B.与相同浓度的盐酸反应生成氢气的速率比生铁的快 |
| C.在潮湿的空气中比生铁容易被腐蚀 |
| D.在冷的浓硝酸中可钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )| A.2a2<a1< 197 |
| B.2a2>a1 >197 |
| C.2a2 = a1 >197 |
| D.2a2 = a1 = 197 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。
PCl3(g)+Cl2(g)的K=4.6×10-3mol·L-1。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com