
| 装置 | 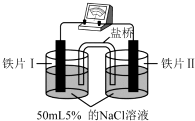 | 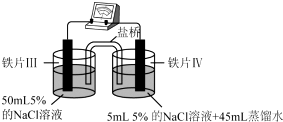 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 | |
| C. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等 | |
| D. | 铁片Ⅳ的电极反应式为Fe-3e-=Fe3+ |
分析 对比两个盐桥的双液装置,图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,图2中因两溶液中氯化钠的浓度不相等,因此发
生的是电化学腐蚀,且浓度大的一极发生的反应是Fe-2e-=Fe2+,可以用K3[Fe(CN)6]溶液检验.
解答 解;A、图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等,电流计指针未发生偏转,铁片Ⅰ、铁片Ⅱ均被腐蚀,故A错误;
B、图2中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极发生的反应是Fe-2e-=Fe2+,可以用K3[Fe(CN)6]溶液检验亚铁离子的存在,进而判断电池的正、负极,故B正确;
C、Ⅰ、Ⅲ中电解质溶液的浓度不同,所以二者的腐蚀速率不相等,故C错误;
D、铁片Ⅳ的电极反应式为Fe-2e-=Fe2+,故D错误.
故选B.
点评 本题考查了原电池原理的分析应用,电极反应和电极判断,注意原电池的构成条件和原理是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 及时分离出NO2气体 | B. | 适当升高温度 | ||
| C. | 增大O2的浓度 | D. | 选择高效催化剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
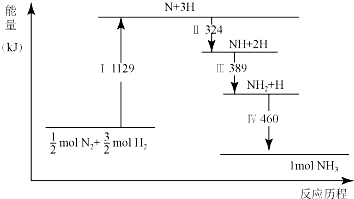
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅳ中NH2与H2生成NH3 | ||
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | D. | N2(g)+3H2(g)?2NH3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com