
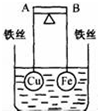
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
分析 杠杆为导体时,向烧杯中央滴入浓CuSO4溶液,构成Fe、Cu原电池,Fe为负极,发生Fe-2e-═Fe2+,Cu为正极,发生Cu2++2e-═Cu;
当杠杆为绝缘体时,只发生Fe与硫酸铜溶液的反应,以此来解答.
解答 解:杠杆为绝缘体时,只发生Fe与硫酸铜溶液的反应,在Fe的表面附着Cu,质量变大,则A端高,B端低;
杠杆为导体时,向烧杯中央滴入浓CuSO4溶液,构成Fe、Cu原电池,Fe为负极,发生Fe-2e-═Fe2+,Cu为正极,发生Cu2++2e-═Cu,则A端低,B端高;
故选D.
点评 本题考查原电池及化学反应,明确杠杆是否导电及发生的反应是解答本题的关键,学生容易忽略杠杆为绝缘体时的情况,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素( )的反应 )的反应 | ||
| C. | 空气净化器过滤净化空气 | D. | 消毒柜通电产生臭氧的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
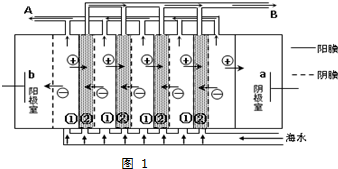
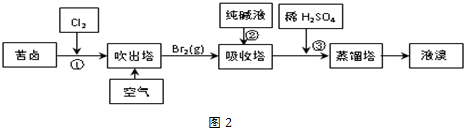
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
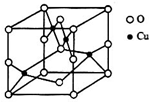 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
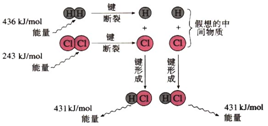
| A. | 氯化氢分子的电子式: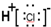 | |
| B. | 该反应是工业制取盐酸的化学反应原理 | |
| C. | 形成1molH-Cl键要吸收431 kJ的能量 | |
| D. | 该反应中反应物总能量小于生成物总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com