
| A. | 用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
分析 A.乙烯和丙烯都能够时酸性高锰酸钾溶液褪色;
B.苯不与溴水反应;
C.水解后溶液中应该先加碱至碱性,再检验葡萄糖;
D.铜丝在酒精灯上加热后,生成CuO具有氧化性,可氧化乙醇.
解答 解:A.乙烯和CH2=CH-CH3都含有碳碳双键,二者与酸性高锰酸钾溶液的反应现象相同,无法用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3,故A错误;
B.制取溴苯应该用液溴,苯不与溴水反应,故B错误;
C.水解后先加碱至碱性,再检验葡萄糖,则取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,应该先加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,否则稀硫酸与银氨溶液反应,干扰了实验结果,故C错误;
D.铜丝在酒精灯上加热后,生成CuO具有氧化性,可氧化乙醇,铜丝恢复成原来的红色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混物质制备、检验、鉴别等,侧重物质性质及实验操作细节的考查,选项C为易错点,注意方案的合理性、操作性分析,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题

| A. | 1mol L分别与足量NaOH和H2反应,最多可消耗2mol NaOH和8mol H2 | |
| B. | 双酚A与苯酚互为同系物 | |
| C. | 与有机酸M含相同官能团的同分异构体还有2种 | |
| D. | 化合物L、双酚A和有机酸M 均能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(CH3)4 1,1,2,2-四甲基甲烷 | |
| B. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2CH(OH)CH3 2-丁醇 | |
| D. | CH3CH2CH2Br 溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯酸钾制取氧气时可加入少量的高锰酸钾以加快反应速率 | |
| B. | 为加快制取氢气的速率用锌粉代替锌粒 | |
| C. | 为降低HNO3与Cu反应制备NO2的速率可以采用稀硝酸代替浓硝酸 | |
| D. | 为了延长食品的保质期在食品包装袋中加入硅胶、硫酸亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )| A. | 叶绿素属于高分子化合物 | |
| B. | 在一定条件下,叶绿素能发生加成、水解、酯化等反应 | |
| C. | 叶绿素分子中含有两种类型的双键 | |
| D. | 叶绿素中Mg2+与四个N之间结合方式不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
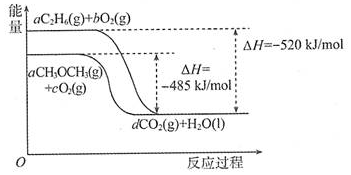
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
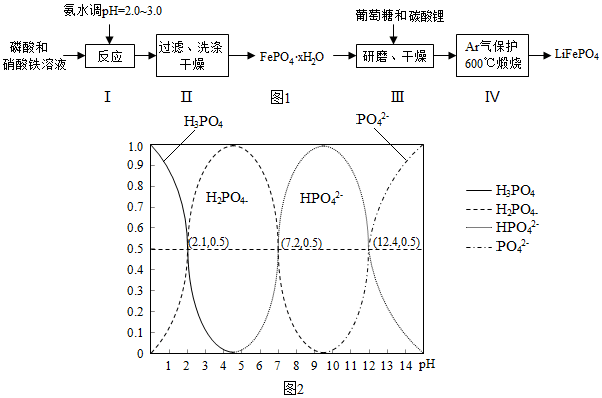
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com