
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已
知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的pH 约为12:ClO-+ H2O
约为12:ClO-+ H2O
 HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
下列有关硝酸化学性质的叙述中,正确的是 ( )
A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色
B.硝酸能与Na2CO3反应,但不生成CO2
C.硝酸可与Na2S反应制得H2S气体
D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为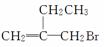 。下列关于该物质的说法中正确的是( )
。下列关于该物质的说法中正确的是( )
A.该物质可以发生水解反应
B.该物质能和AgNO3溶液反应产生AgBr沉淀
C.该物质可以发生消去反应
D.该物质分子中至多有4个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液PH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究
“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
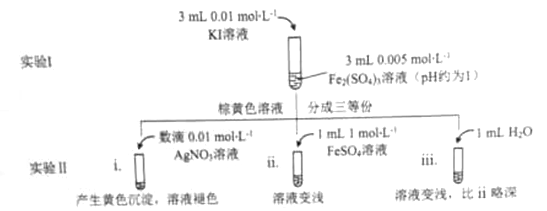
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应 的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
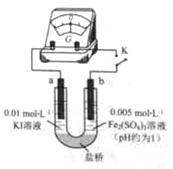
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是:
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
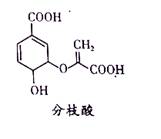 A.分子中含有2种官能团
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
| T | ||
| X | Y | Z |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
A.R位于元素周期表中第二周期第VA族
B.R能分别与X、Z形成共价化合物
C.气态氢化物稳定性:Y>T
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com