
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
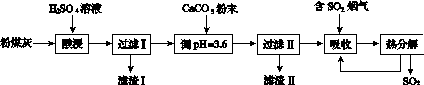
(1)酸浸时反应的化学方程式为____________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是__________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
(1)Al2O3+3H2SO4===Al2(SO4)3+3H2O SiO2
(2)CaSO4 3CaCO3+2Al3++3SO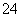 +3H2O===2Al(OH)3+3CaSO4+3CO2↑
+3H2O===2Al(OH)3+3CaSO4+3CO2↑
(3)溶液中的部分SO 被氧化成SO
被氧化成SO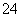 减小
减小
[解析] (1)粉煤灰中的Al2O3能与H2SO4反应生成Al2(SO4)3,而SiO2不能与H2SO4反应,因而滤渣Ⅰ为SiO2。(2)滤液为Al2(SO4)3,与CaCO3反应生成微溶物CaSO4,因而滤渣Ⅱ为CaSO4。溶液中存在Al3++3H2OAl(OH)3+3H+,CaCO3+2H+=== Ca2++H2O+CO2↑,溶液的pH偏高,碱性增强,会促进Al3+水解,铝元素容易转化为Al(OH)3沉淀而导致溶液中铝元素含量降低。(3)+4价S具有较强还原性,溶液中的SO 容易被氧化为SO
容易被氧化为SO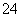 。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。
。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。


科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
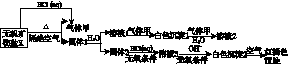
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为__________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_____________________________________________________,并设计实验方案验证该反应的产物:__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
|
| 实验Ⅰ | 2mL银氨溶液和数 滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ | 2mL银氮溶液和 数滴浓氨水 | 有气泡产生: 一段时间后,溶液 无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.
b.AgOH不稳定,极易分解为黑色Ag2O
(I)配制银氨溶液所需的药品是 。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是 。
②产生Ag2O的原因是 。
(3)该同学对产生银镜的原因提出瑕设:可能是NaOH还原Ag2O。实验及现象:向AgNO3
 溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在NaOH存在下.可能是NH3,
还原Ag2O。用右图所示装置进行实验.现象:
出现银镜。在虚线框内画出用生石灰和浓
氨水制取NH3的装置简图(夹持仪器 略)。
略)。
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成.由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3,还原Ag2O的反应.进行如下实验:
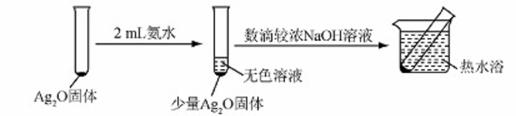
有部分Ag2O溶解在氨水中,该反应的化学方程式是 。
验结果证实假设成立,依据的现象是 。
用HNO3,消洗试管壁上的Ag,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
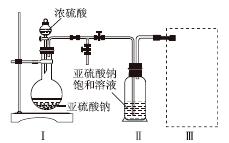
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
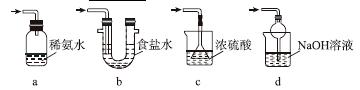
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于浓H2SO4.稀H2SO4的叙述中正确的是( )
A. 浓H2SO4.稀H2SO4都难挥发
B. 浓H2SO4.稀H2SO4都能氧化金属Zn,且反应实质相同
C. 浓H2SO4.稀H2SO4在加热时都能与铜反应
D.浓H2SO4.稀H2SO4在常温下都能用铁制容器贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列化学方程式
(1)Cu与浓硫酸反应 _____________________________________________________
(2)C与浓硫酸反应 ______________________________________________________
(3)Cu与浓硝酸反应 _____________________________________________________
(4)Cu与稀硝酸反应 _____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为 mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)≈ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是 。
A.选用480 mL的容量瓶
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com