
| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
分析 A.乙醇燃烧所有的氢元素均生成水;
B.根据乙醇和金属钠反应的实质来回答;
C.1个乙醇分子中含有一个氧原子,不能说明乙醇分子中有一个氢原子与其他氢原子不同;
D.乙醇溶于水的过程不发生化学反应,乙醇与水能形成氢键.
解答 解:A.乙醇燃烧所有的氢元素均生成水,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故A错误;
B.1mol乙醇跟足量的Na作用得0.5molH2,很明显乙醇中的6个氢只有一个能变为氢气,这个氢与其他氢不同,故B正确;
C.CH3OCH3分子中含有一个氧原子,但1个分子中6个氢原子相同,所以1个乙醇分子中含有一个氧原子,不能说明乙醇分子中有一个氢原子与其他氢原子不同,故C错误;
D.乙醇与水能形成氢键,故乙醇与水能以任意比互溶,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故D错误;
故选B.
点评 本题考查乙醇中羟基的性质以及乙醇的结构知识,题目难度不大.注意从结构考虑物质的性质.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 城市垃圾分类处理 | B. | 推广使用清洁能源 | ||
| C. | 过量使用化肥、农药 | D. | 推广使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋蒸熏对房间消毒杀菌 | |
| B. | SO2通入品红中溶液变为无色 | |
| C. | 红糖水中加入活性炭溶液变为无色 | |
| D. | 少量胆矾粉末加入到浓硫酸中固体变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
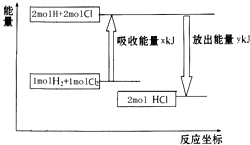
| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
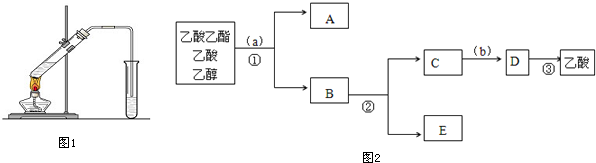
 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
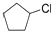
 .
.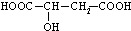
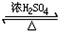 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com