
【题目】2020年一月一场突如其来的新冠肺炎席卷全球,该病最明显的症状就是出现发热,市售体温枪能快速的检测人体体温,该体温枪所用的电池具有使用寿命长、容量大等特点,应用十分广泛。该种电池由氧化银作为正极,金属锌粉作为负极,电解液为氢氧化钾或氢氧化钠,电池的总反应方程式为Zn + Ag2O + H2O = Zn(OH)2 + 2Ag,根据信息回答下列问题:
(1)该电池在测体温时,将 ________能转化为_________能。
(2)放电时,负极电极反应:_________________;正极电极反应:___________________。
(3)整个过程电解质溶液的pH值__________(填“增大”“减小”或“不变”)。
(4)试计算在放电过程中转移3NA个电子时,正极________(填“增大”或“减小”)的质量的为______________。
【答案】化学 电 Zn-2e-+2OH-=Zn(OH)2 Ag2O+2e-+H2O=2Ag+2OH- 增大 减小 24g
【解析】
(1)原电池是将化学能转化为电能。
(2)放电时,负极为锌,失去电子变为Zn(OH)2;正极为Ag2O,得到电子变为Ag和OH-。
(3)根据总反应,水不断消耗,氢氧化钠浓度增大。
(4)根据总反应,正极1 mol Ag2O反应生成2 molAg,质量减少16g,转移2mol电子。
(1)该电池在测体温时,将化学能转化为电能;故答案为:化学;电。
(2)放电时,负极电极反应:Zn 2e-+2OH- = Zn(OH)2;正极电极反应:Ag2O + 2e-+H2O = 2Ag+2OH-;故答案为:Zn 2e-+2OH- = Zn(OH)2;Ag2O + 2e-+H2O = 2Ag+2OH-。
(3)根据总反应方程式Zn + Ag2O + H2O = Zn(OH)2 + 2Ag,水不断消耗,氢氧化钠浓度增大,因此整个过程电解质溶液的pH值增大;故答案为:增大。
(4)根据总反应Zn + Ag2O + H2O = Zn(OH)2 + 2Ag,正极1 mol Ag2O反应生成2 molAg,质量减少16g,转移2mol电子,在放电过程中转移3NA个电子时,正极减小的质量的为![]() ;故答案为:减少;24g。
;故答案为:减少;24g。


科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
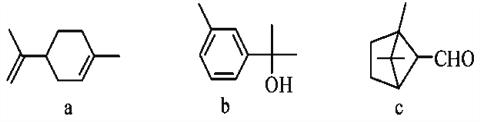
A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )
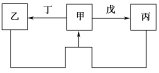
选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
A.x=2
B.2min时,容器内的压强为开始时的80%
C.2min时,B的反应速率为0.1mol·L-·min-
D.A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。

(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl气体溶解在1 L水中(水的密度为1 g·cm-3),所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有体积为22.4 LD.所得溶液的溶质质量分数:w=![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
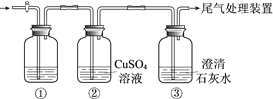
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com