
【题目】(1)1mol乙醛分子中含有σ键的数目为________,乙酸的沸点明显高于乙醛,其主要原因是____________________________________________。
(2)与OH-互为等电子体的一种分子为________________(填化学式)。
(3)短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。
①C元素原子基态时的价电子排布式为________,若A元素为非金属元素,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
②当n=2时,B的最简单气态氢化物的分子构型为________,中心原子的杂化方式为________,BC2属于________分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于________晶体。
(4)BF3与一定量的水形成晶体Q[(H2O)2·BF3],Q在一定条件下可转化为R:
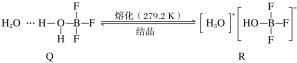
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(5)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________。
【答案】6NA 乙酸分子之间能形成氢键,乙醛分子之间不能形成氢键 HF 1s22s22p4 σ 正四面体 sp3 非极性 原子 ad < ![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚
【解析】
(1)乙醛的结构式为![]() ,根据结构确定σ键数目;分子之间能形成氢键,则沸点升高;
,根据结构确定σ键数目;分子之间能形成氢键,则沸点升高;
(2)OH-中含有2个原子,10个电子;
(3)短周期元素A、B、C、D,A元素的原子最外层电子排布为ms1,A位于IA族;B元素的原子价电子排布为ns2np2,B位于IVA族;C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,C为氧元素;D元素原子的M电子层的P亚层中有3个电子,则D元素原子电子排布式为1s22s22p63s23p3,D为P元素;
(4)非金属元素原子之间为共价键,B原子与O原子间为配位键,分子之间存在范德华力,水分子中的O原子和羟基上的H原子易形成氢键;
(5)分子内形成氢键,使该微粒中酚羟基更难电离出H+,酸性小;
(1)乙醛的结构式为![]() ,单键都是σ键,双键中有一个σ键和一个π键,则一个乙醛分子含有6个σ键,1mol乙醛分子中含有σ键的数目为6NA;乙醛分子中氢原子都与碳原子相连,乙醛分子之间不能形成氢键,而乙酸(CH3COOH)分子有一个氢原子与氧原子相连,乙酸分子之间能形成氢键,则乙酸的沸点明显高于乙醛;
,单键都是σ键,双键中有一个σ键和一个π键,则一个乙醛分子含有6个σ键,1mol乙醛分子中含有σ键的数目为6NA;乙醛分子中氢原子都与碳原子相连,乙醛分子之间不能形成氢键,而乙酸(CH3COOH)分子有一个氢原子与氧原子相连,乙酸分子之间能形成氢键,则乙酸的沸点明显高于乙醛;
(2)OH-中含有2个原子,10个电子,与OH-互为等电子体的分子为HF;
(3)短周期元素A、B、C、D,A元素的原子最外层电子排布为ms1,则A位于IA族;B元素的原子价电子排布为ns2np2,B位于IVA族;C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,C为氧元素;D元素原子的M电子层的P亚层中有3个电子,则D元素原子电子排布式为1s22s22p63s23p3,D为P元素;
①C为氧,基态原子的价电子排布式为1s22s22p4;若A元素为非金属元素,则A为H,H与O形成的化合物为水、过氧化氢,其共价键属于σ键;
②n=2时,B为C,其最简单气态氢化物为甲烷,分子构型为正四面体;中心C原子为sp3杂化;CO2为直线型结构,分子中正负电荷中心重合,属于非极性分子;当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
(4)非金属元素原子之间为共价键,B原子与O原子间为配位键,分子之间存在范德华力,水分子中的O原子和羟基上的H原子易形成氢键,不存在离子键和金属键,答案为ad;
(5)![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
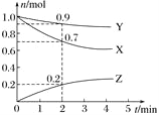
A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
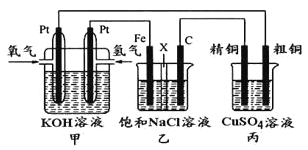
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________(填“正极”或“负极”),负极的电极反应式为_________________。
(2)乙装置中铁电极为_______(填“阳极”或“阴极”),石墨电极(C)上发生_____反应(填“氧化”或“还原”),其电极反应式为___________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____;丙装置中阴极析出铜的质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
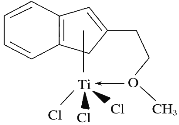
组成M的元素中,电负性最大的是__________(填名称)。
(2)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为________。
(3)①已知Al 的第一电离能为578 kJ·mol-1、第二电离能为1 817 kJ·mol-1、第三电离能为2 745 kJ·mol-1、第四电离能为11 575 kJ·mol-1。请解释其第二电离能增幅较大_______________________________。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
②第二电离能I(Cu)________(填“>”或“<”)I (Zn)。
(4)在硅酸盐中,SiO44—四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根(其中硅原子数为n):其中Si原子的杂化形式为_________,Si与O的原子数之比为__________,化学式为____________。
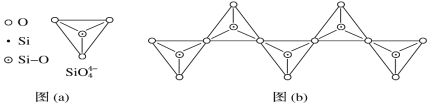
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下______L硫化氢含有相同数目的氢原子。
(2)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______,R的相对原子质量为_________。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该混合气体中含CO___g,所含CO2在标准状况下的体积为_______L。
(4)同温同压下,SO2与Cl2的密度之比为______;若质量相同,两种气体的体积比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
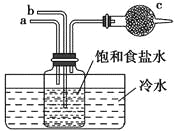
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A. 1mol苯分子中含有C=C双键数目为3NA
B. 标准状况下,11.2LCCl4中含有的共价键数目为2NA
C. 1mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA
D. 常温常压下,17g羟基含有的电子总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是
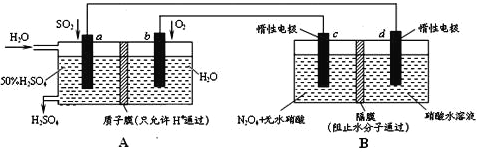
A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com