
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是__。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__。
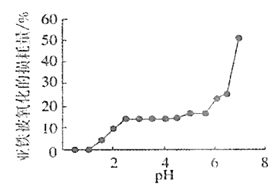
(4)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为__。(写出一条即可)
(5)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为__。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
实验方案 | 现象 |
步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
步骤2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为__。
【答案】防止Fe2+被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(防止O2将Fe2+氧化) 增强溶液的酸性(降低溶液的pH值等) 2Fe3++Cu=2Fe2++Cu2+ 0.1 2Cu2++4SCN-=2CuSCN↓+(SCN)2
【解析】
(1)铁和硫酸铁反应生成硫酸亚铁,在FeSO4溶液中需加入少量铁屑2Fe3++Fe=3Fe2+,其目的是防止硫酸亚铁被氧化,故答案为:防止Fe2+被氧化。
(2)氯气具有氧化性,能氧化硫酸亚铁为硫酸铁反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响,故答案为:隔离空气(排除氧气对实验的影响)。
(4)根据图像分析可知,pH越小,亚铁离子不容易被氧化损耗,越稳定,所以增强Fe2+稳定性的措施为降低pH或增强酸性,故答案为:增强溶液的酸性(降低溶液的pH值等)。
(5)①硫酸铁与Cu粉反应生成硫酸亚铁和硫酸铜,其离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+。
②由反应2Fe3++Cu=2Fe2++Cu2+可知,图1中得到溶液中Fe2为0.2mol/L,Cu2+为0.1mol/L,分别取4mL0.2mol/L的FeSO4溶液和4mL0.1mol/L的CuSO4溶液,滴加3滴0.1mol/L的KSCN溶液,观察实验现象,前者无明天现象,后者有白色沉淀生成可知,CuSO4与KSCN反应生成CuSCN是难溶于水的白色固体,其离子反应方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2,故答案为:0.1;2Cu2++4SCN-=
2CuSCN↓+(SCN)2。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲利用MnO2和浓盐酸及如图所示装置制备Cl2。下列分析中不正确的是
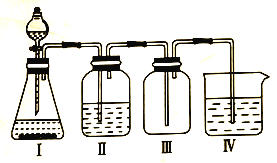
A.I中缺少加热装置
B.Ⅱ为净化Cl2的装置,其盛放的是NaOH溶液
C.Ⅲ为收集Cl2的装置
D.Ⅳ中处理多余的Cl2时,Cl2既作氧化剂,又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
实验 编号 | 实验 温度 | 试管中所加试剂及其用量/mL | 溶液褪至无 色所需时间 /min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式 ______,当该反应以表中数据反应完全时转移电子数为______NA。
(2)V1=_______mL。
(3)根据表中的实验①、②数据,可以得到的结论是 _______。
(4)探究温度对化学反应速率的影响,应选择 _______(填实验编号)
(5)该小组根据经验绘制了n(Mn 2+)随时间变化的趋势如图1所示,但有同学查阅已有实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图2所示。
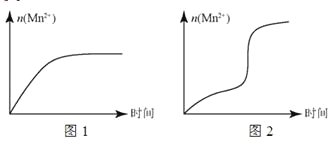
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
实验温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | ||||
0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①小组同学提出的假设是________。
②若该小组同学提出的假设成立,应观察到________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
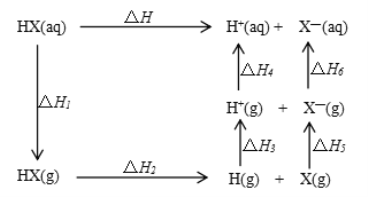
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所设计了一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
则8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,氨硼烷还可作燃料电池,其工作原理如图1所示。氨硼烷电池工作时正极的电极反应式为__________。

(3)常见含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,写出其化学方程式_______。![]() 为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
(4)燃油汽车尾气含有大量的NO,在活化后的V2O5催化作用下,氨气将NO还原成N2的一种反应历程如图3所示。
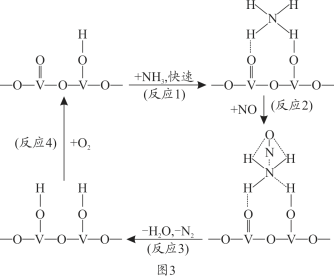
根据图写出总反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试用VSEPR理论判断下列分子或离子的立体构型,并判断中心原子的杂化类型:
(1)H2O____________形,杂化类型_________;
(2)CO32-__________形,杂化类型_________;
(3)SO32-__________形,杂化类型_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
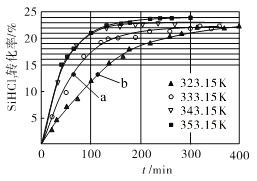
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6 molL-1。对此反应速率的表示正确的是( )
①用A表示的反应速率是0.4 molL-1min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 molL-1min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①②
B. ③
C. ①
D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com