
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
分析 高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO,反应的化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,结合反应特征和平衡移动原理分析判断选项.
解答 解:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,反应达到平衡状态后移走少量CO,平衡正向进行,
A、平衡正向进行,二氧化碳减小,一氧化碳增加,CO2和CO浓度比减小,故A不符合;
B、移走少量CO,平衡正向进行,气体质量减小,体积不变,混合气体的密度减小,故B不符合;
C、移走少量CO,平衡正向进行反应物转化率增大,故C符合;
D、移走少量CO,达到新的平衡时二氧化碳减小,一氧化碳增多,所以CO的体积分数增大,故D符合;
故选:CD.
点评 本题考查了化学平衡影响因素分析判断,主要是改变物质浓度对反应平衡的理解应用,注意一氧化碳体积分数的变化分析,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 此元素有三种同位素 | |
| B. | 其中质量数为79的同位素原子占原子总数 $\frac{1}{2}$ | |
| C. | 其中一种同位素质量数为80 | |
| D. | 此元素单质的平均相对分子质量为160 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
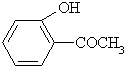 乙:
乙: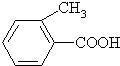 丙:
丙: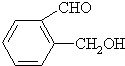
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
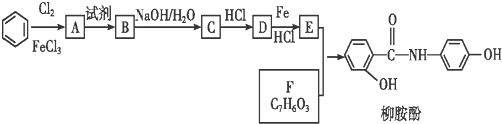
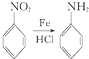
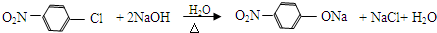
 .
.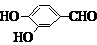 、
、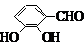 、
、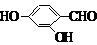 、
、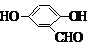 (其中三种)(写出3种).
(其中三种)(写出3种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都可以与钠反应生成氢气 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与溴水发生化学反应造成溴水褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
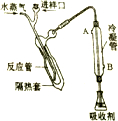 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: )
) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com