
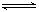 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 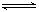 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (用离子方程式表示);溶液中各离子浓度由大到小的顺序 ;向此溶液中加入AlCl3溶液,观察到的现象是 ,反应的离子方程式为 。
(用离子方程式表示);溶液中各离子浓度由大到小的顺序 ;向此溶液中加入AlCl3溶液,观察到的现象是 ,反应的离子方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com