
【题目】某化学兴趣小组为研究过氧化钠与SO2的反应情况,进行如下探究。
(1)[提出假设]
向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体______,证明SO2部分被氧化。
(2)[定性研究]
为验证假设三,该小组进行如下研究,请你完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
取适量反应后的固体放入试管中,____ | ______ |
(3)[定量研究]
通过测量气体的体积判断发生的化学反应,实验装置如图:
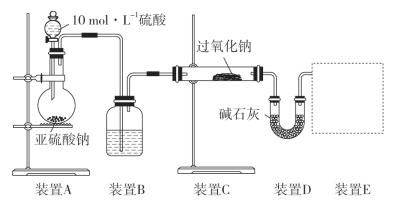
①装置B中所盛装试剂的名称为________。
②装置D的作用是__________。
③请画出实验装置E_____。
④实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据进行填表判断。
SO2被氧化的程度 | V与m1或m2的关系 |
未被氧化 | |
完全被氧化 | V=0 |
部分被氧化 | _____ |
【答案】Na2SO3和Na2SO4的混合物 加入BaCl2溶液,再加入稀盐酸 加入BaCl2溶液有白色沉淀产生,加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠 浓硫酸 吸收未反应的SO2  0<V<
0<V<![]()
【解析】
(1)SO2具有较强的还原性,而Na2O2具有较强的氧化性,两者反应时有SO2全部被氧化、部分被氧化和没有被氧化三种合理假设。根据假设可以预测出反应后固体的成分,若部分被氧化既有Na2SO3又有Na2SO4;
(2)SO2被氧化的产物为Na2SO4,只要证明所得固体中既含有Na2SO4,又含有Na2SO3即可确定SO2部分被氧化,可根据BaSO4不溶于盐酸而BaSO3溶于盐酸来验证,即取适量反应后的固体放入试管中,加入BaCl2溶液有白色沉淀产生,加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠。
(3)①从装置A中出来的气体含有水蒸汽,二氧化硫为酸性气体,不能选择碱性干燥剂,浓硫酸具有吸水性,可以除去二氧化硫中水。
②二氧化硫为酸性氧化物,可以用碱石灰吸收,故D的作用吸收未反应的SO2;
③若亚硫酸钠未被氧化,则与过氧化钠反应生成氧气,氧气难溶于水,可以用排水法测量生成氧气的体积,所以E装置为: ;
;
④若SO2完全被氧化,则发生反应SO2+Na2O2=Na2SO4,无O2生成;若SO2未被氧化,则发生反应:
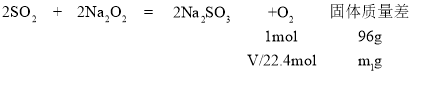
故V=![]()
若SO2部分被氧化,则装置C中固体增加的质量增大,生成O2的体积减小,即0<V<![]() 。
。


科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
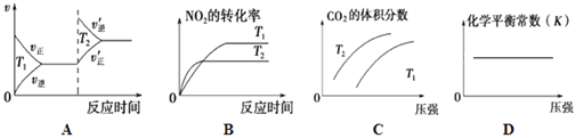
②对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是_______(填序号)。
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。

(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
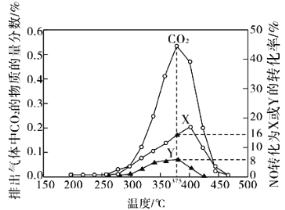
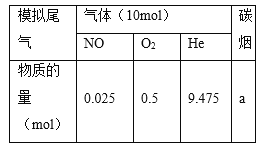
①375℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程中会产生剧毒气体硫化氢(H2S),可通过间接电化学法除去,其原理如图所示。下列说法错误的是

A.反应池中处理硫化氢的反应是H2S+2Fe3+=2Fe2++S↓+2H+
B.电极a为阳极,电极b为阴极
C.若交换膜为质子(H+ )交换膜,则NaOH溶液的浓度逐渐变大
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。下列说法中一定正确的是
A. Ⅹ的原子半径比Y的原子半径大
B. Ⅹ形成的氢化物分子中不含非极性键
C. Z、W的最高价氧化物对应的水化物是酸
D. Y单质与水反应,水可能作氧化剂也可能作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任取两种烃混合,完全燃烧生成的CO2的物质的量小于H2O的物质的量,则这两种烃的组合不可能是 ( )
A.烷烃和烷烃B.烷烃和烯烃C.烷烃和炔烃D.烯烃和炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
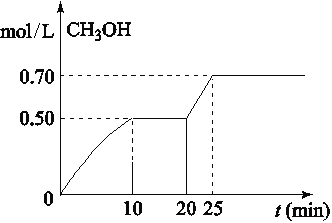
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计 实验制备少量的S2Cl2,査阅资料知:
①干燥的氯气在 110℃~140℃与硫反应,即可得到 S2Cl2。
②S 的熔点为 112.8℃、沸点为 444.6℃;S2Cl2 的熔点为-76℃、沸点为 138℃。
③S2Cl2+Cl2![]() 2SCl2。
2SCl2。
④S2Cl2 易和水发生歧化反应。

该小组设计的制备装置如如图(夹持仪器和加热装置已略去)
(1)连接好实验装置后的第一步实验操作是____________。
(2)A 装置中制取氯气的离子反应方程式_____________。
(3)装置 B、C 中的试剂分别是_____________,_____________; 若实验中缺少 C 装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(4)该实验的操作顺序应为_____________(用序号表示)。
①加热装置 A ②加热装置 D ③通冷凝水 ④停止加热装置 A ⑤停止加热装置 D
(5)图中 G 装置中应放置的试剂为______________,其作用为______________。
(6)在加热 D 时温度不宜过高,其原因是_______________; 为了提高 S2Cl2 的纯度,关键的操作是控制好温度和______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com