
【题目】对羟基苯甲酸乙酯(![]() )又称为尼泊金乙酯,可用作食品防腐剂和化妆品防霉剂。现以有机物X(分子C9H10O2)为原料合成尼泊金乙酯的路线如下(无机产物略):
)又称为尼泊金乙酯,可用作食品防腐剂和化妆品防霉剂。现以有机物X(分子C9H10O2)为原料合成尼泊金乙酯的路线如下(无机产物略):
已知:①苯环上的卤原子(如![]() )在稀NaOH溶液中难以发生水解反应:
)在稀NaOH溶液中难以发生水解反应:
②烯醇不稳定,很容易自动发生转化反应:RCH===CHOH―→RCH2CHO。
回答下列问题:
(1)对羟基苯甲酸乙酯分子中能和NaOH反应的官能团有________(填名称)。
(2)在①~④的反应中,属于取代反应的有__________________ 个。
(3)X的结构简式为________;D的核磁共振氢谱有________组峰。
(4)写出下列反应的化学方程式:反应②______________________________;
反应④__________________________________________________________。
(5)对羟基苯甲酸甲酯(分子式为C8H8O3)也具有消毒防腐性质,它的同分异构体很多,其中符合下列条件的同分异构体有________种。
Ⅰ.遇FeCl3溶液呈紫色;Ⅱ.苯环上的一氯代物有3种;Ⅲ能发生银镜反应和水解反应。
【答案】 羟基(或酚羟基)、酯基 3 ![]() 4
4 ![]()
![]() 10
10
【解析】(1)对羟基苯甲酸乙酯分子中含有酚羟基和酯基,二者均能和NaOH反应;(2)D与乙醇发生酯化反应生成对羟基苯甲酸乙酯,则D的结构简式为![]() 。A连续氧化生成C,M水解生成A和E,说明A是
。A连续氧化生成C,M水解生成A和E,说明A是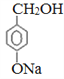 ,B是
,B是![]() ,C是
,C是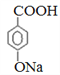 。根据反应④的条件可知该反应是卤代烃的消去反应,结合已知信息②可知F的结构简式为CH3CHO,乙醛氧化生成K,则K的结构简式为CH3COOH,E的结构简式为CH3COONa。因此结合已知信息①可知M的结构简式为
。根据反应④的条件可知该反应是卤代烃的消去反应,结合已知信息②可知F的结构简式为CH3CHO,乙醛氧化生成K,则K的结构简式为CH3COOH,E的结构简式为CH3COONa。因此结合已知信息①可知M的结构简式为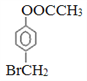 ,所以X的结构简式为
,所以X的结构简式为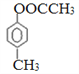 。根据以上分析可知①~④的反应中,属于取代反应是①②③,合计是3个。(3)X的结构简式为
。根据以上分析可知①~④的反应中,属于取代反应是①②③,合计是3个。(3)X的结构简式为 ;D的结构简式为
;D的结构简式为![]() ,其中核磁共振氢谱有4组峰。(4)反应②方程式为
,其中核磁共振氢谱有4组峰。(4)反应②方程式为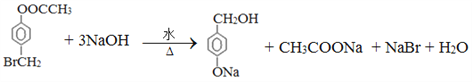 ;反应④的方程式为CH3CHBrOH+NaOH
;反应④的方程式为CH3CHBrOH+NaOH![]() CH3CHO+NaBr+H2O。(5)Ⅰ.遇FeCl3溶液呈紫色,说明含有酚羟基;Ⅱ.苯环上的一氯代物有3种;Ⅲ能发生银镜反应和水解反应,说明是甲酸形成的酯基,因此三个取代基是-OH、-CH3、-OOCH,根据定二移一法可知在苯环上的位置是10种,即有10种同分异构体。
CH3CHO+NaBr+H2O。(5)Ⅰ.遇FeCl3溶液呈紫色,说明含有酚羟基;Ⅱ.苯环上的一氯代物有3种;Ⅲ能发生银镜反应和水解反应,说明是甲酸形成的酯基,因此三个取代基是-OH、-CH3、-OOCH,根据定二移一法可知在苯环上的位置是10种,即有10种同分异构体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。

反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了如下3个实验方案,用以检验淀粉的水解程度:
甲方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 ![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解
乙方案:淀粉液 ![]() 水解液
水解液 ![]() 无银镜现象
无银镜现象
结论:淀粉尚未水解
丙方案:淀粉液 ![]() 水解液
水解液 ![]() 中和液
中和液 
结论:淀粉水解完全
上述三种方案操作是否正确 说明理由。上述三种方案结论是否正确 说明理由。 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/LH2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 | a |
下列叙述正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-l·min-l
B. 反应到6 min时,c(H2O2)=0.30mol·L-l
C. 反应到6 min时,H2O2分解了60%
D. 12 min时,a=33.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图所示。

(1)“苦卤”到“含Br2的海水”过程____(填“是”或“不是”)氧化还原反应。
(2)步骤④利用了S02的还原性,反应的离子方程式为____。
(3)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,其原因是____。
(4)若处理1 m3海水需要消耗0.45 molSO2,不考虑转化过程中溴的损耗,则海水中溴离子的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl- 离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为2:2:1,则上述三种溶液的体积比是( )
A. 9:3:1 B. 3:2:1 C. 6:3:1 D. 9:4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是()
A.K+、Ag+、NO3—、Cl—B.Ba2+、Na+、CO32-、OH-
C.Al3+、Fe3+、SO42-、Cl-D.H+、K+、CO32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com