
| A. | 用新制氢氧化铜检验牙膏中的甘油,现象是看到产生蓝色沉淀 | |
| B. | 为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 | |
| C. | 做银镜反应实验后,试管内壁上的附着物用稀硝酸洗涤 | |
| D. | 用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂 |
分析 A.甘油与新制氢氧化铜反应生成绛蓝色的溶液;
B.摩擦烧杯壁,可以找一个“中心”聚集起来让晶体析出;
C.硝酸与Ag反应;
D.用纸上层析法分离时,Cu2+与氨水发生络合反应,滤纸呈蓝色.
解答 解:A.甘油与新制氢氧化铜反应生成绛蓝色的溶液,而不是沉淀,故A错误;
B.为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁,易使晶体聚集,故B正确;
C.硝酸与Ag反应,则做银镜反应实验后,试管内壁上的附着物用稀硝酸洗涤,故C正确;
D.Cu2+与氨水发生络合反应,滤纸呈蓝色,则用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验操作和技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
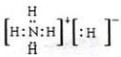 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 亚硝酸钠外观与食盐相似,误食会引起中毒,因此不能用作食品添加剂 | |
| C. | 取试管向其加入适量CoCl2的盐酸溶液,将溶液进行稀释,可以观察到溶液颜色由粉红色变为蓝色 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
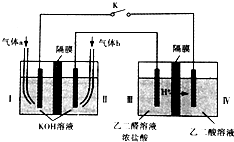 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | 电极Ⅱ上的电极反应式:O2+4e-+2H2O═4OH- | |
| B. | 电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O | |
| C. | 乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO | |
| D. | 若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI或H2和I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

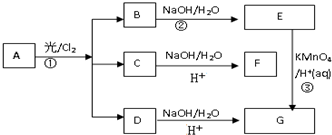
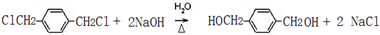 .
.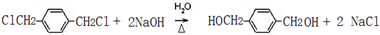 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com