
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
分析 由元素在周期表的位置可知,①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是Cl,⑧是Ar,⑨是K,⑩是Br.
(1)周期表中F的非金属性最强;
(2)高氯酸为所有含氧酸中酸性最强的酸,氢氧化铝具有两性;
(3)上述元素对应碱中,KOH的碱性最强,Al与KOH溶液反应生成偏铝酸钾和水;
(4)氯气比溴活泼,因氯气可置换出溴.
解答 解:由元素在周期表的位置可知,①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是Cl,⑧是Ar,⑨是K,⑩是Br.
(1)在这些元素中,非金属性最强的元素是F,故答案为:F;
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3,故答案为:HClO4;Al(OH)3;
(3)上述元素对应碱中,KOH的碱性最强,Al与KOH溶液反应生成偏铝酸钾和水,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用化学反应2NaBr+Cl2=2NaCl+Br2说明该事实,故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物及相关反应原理的应用,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
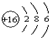 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com