
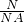 =
= =0.2mol,0.2mol的氢气的质量为 m=n×M=0.2mol×2g/mol=0.4g,故A正确;
=0.2mol,0.2mol的氢气的质量为 m=n×M=0.2mol×2g/mol=0.4g,故A正确; =
=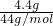 =0.1mol,1mol CO2的含有3 mol原子,0.1mol CO2的含有0.3 mol原子,根据N=n×NA=0.3mol×NAmol-1=0.3 NA,故B错误;
=0.1mol,1mol CO2的含有3 mol原子,0.1mol CO2的含有0.3 mol原子,根据N=n×NA=0.3mol×NAmol-1=0.3 NA,故B错误; =
= =1mol,因水在标准状况下为液态,所以不能用Vm=22.4mol/L,所以标准状况下,18 g H2O占有的体积不为22.4 L,故C错误;
=1mol,因水在标准状况下为液态,所以不能用Vm=22.4mol/L,所以标准状况下,18 g H2O占有的体积不为22.4 L,故C错误;

 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com