
请回答下列问题:
(1)下列属于无机非金属材料的是
A.高强度水泥 B.钢化玻璃
C.氧化铝陶瓷 D.光导纤维
(2)磷酸钙陶瓷也是一种新型无机非金属材料,它可以用于制成人造骨骼,这是利用这类材料的
A.耐高温特性 B.电学特性
C.光学特性 D.生物功能
科目:高中化学 来源: 题型:
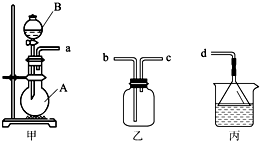 液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 750-970oC | 通电,Na3AIF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com