
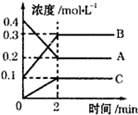
 如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题:
如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图象,回答问题: 2B+C.
2B+C.分析 ①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,结合化学计量数之比等于浓度变化量之比计算;
②结合v=$\frac{△c}{△t}$计算;
③结合反应速率之比等于化学计量数之比计算A的反应速率,然后比较.
解答 解:①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,且△c(A):△c(B):△c(C)=2:2:1,2min时反应达到平衡,则反应方程式为2A 2B+C,
2B+C,
故答案为:2A 2B+C;
2B+C;
②2min内,用B表示的反应速率为$\frac{0.3mol/L-0.1mol/L}{2min}$=0.1mol/(L•min),故答案为:0.1mol/(L•min);
③反应速率之比等于化学计量数之比,则800℃时v(A)=v(B)=0.1mol/(L•min),可知在其他条件下,测得A的反应速率为0.05mol/(L•s)=3mol/(L•min),此时的反应与800℃时相比,比800℃时快,故答案为:A.
点评 本题考查物质的量浓度随时间变化曲线,为高频考点,把握图中浓度变化、速率计算等为解答的关键,侧重分析与应用能力的考查,注意速率单位,题目难度不大.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然橡胶的主要成分是异戊二烯 | |
| B. | 通过物理变化将煤气化和液化,能高效清洁地用煤 | |
| C. | 苯酚能用于环境消毒 | |
| D. | 乙醇是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com